Трећи закон термодинамике бави се понашањем материје са ентропијом која се приближава нули.
Према овом закону, кад год је систем у термодинамичкој равнотежи, његова ентропија се приближава нули.
Други закон термодинамике односи се на ентропију. После тога, трећи закон се појављује као а покушај успостављања апсолутне референтне тачке која одређује ентропију.
Валтхер Нернст (1864-1941) био је физичар који се бавио принципима који су чинили основу за трећи закон термодинамике.
Према Нернсту, ентропија би имала тенденцију да има минималну вредност ако би температура чисте супстанце била једнака или се приближавала апсолутној нули.
За то је Нернст предложио доњу формулу која показује да варијације ентропије (ΔС) и температуре (Т) теже минималним вредностима, односно 0:
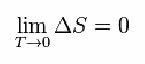
Али шта је Ентропија?
Ентропија то је начин на који се молекули организују у систему. Ова организација се претвара у поремећај, не у смислу збуњености, већ у смислу кретања и агитације молекула.
Што се више молекула може кретати, што су више неорганизовани, то имају више ентропије.
У почетку је Нернст сугерисао да би ентропија коју је предложио била могућа само на савршеним кристалима.
На крају је закључио да температура једнака апсолутној нули не постоји, што трећи закон чини контроверзним законом.
Дакле, за многе физичаре ово није закон већ правило.
После толико година (од 1912), научници покушавају да добију ову температуру или температуре које се све више приближавају апсолутној нули. Тако су открили да је то могуће само у гасовима, одбацујући било коју супстанцу у чврстом или течном стању.
Прочитајте такође:
- Нулти закон термодинамике
- Први закон термодинамике
- Други закон термодинамике
- Вежбе из термодинамике