Нека једињења у својој структури имају двоструке везе које се смењују са једноструким везама. Најпознатији од свих је бензен, чију је структуру 1865. године предложио немачки хемичар Фриедрицх Аугуст Кекуле (1829-1896). Његова структура би била циклична и формирана би од три двоструке везе прошаране са три појединачне везе, као што је приказано на сликама испод:
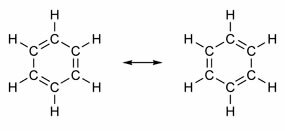
Оба начина представљања бензена су прихватљива, јер је могуће променити електроне у π везама без промене положаја атома. Међутим, нити представља тачно оно што јесте нити објашњава његово понашање. Требало би да се понаша као алкен и изазива реакције додавања, али у пракси се то не дешава. Бензен је прилично стабилан и понаша се као да нема двоструке везе; даје реакције супституције као код алкана.
Амерички научник Линус Паулинг 1930. године предложио је теорију резонанције која је објаснила ову очигледну контрадикцију. Ова теорија је рекла:
„Кад год у структурној формули можемо променити положај електрона без промене положаја атома , стварна структура не неће бити ниједна од добијених структура, већ пре резонантни хибрид тих структура “.
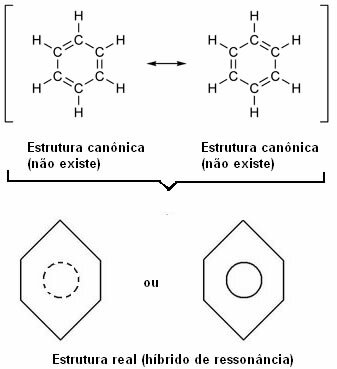
Овај ефекат доказује величина угљеничних веза и удаљеност између њих. Ова удаљеност је средња у односу на једноструку везу (1,54 А) и двоструку везу (1,34 А); која је, према томе, 1,39 А, због ефекта резонанце.
Овај ефекат се може видети и у структури молекула озона (О3), како је приказано испод:
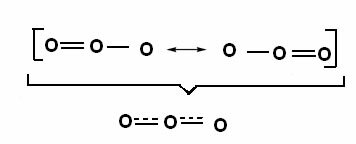
Канонске структуре и хибриди озонске резонанце.
Јеннифер Фогаца
Дипломирао хемију
Бразилски школски тим.
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/ressonancia-compostosquimicos.htm

