Француски хемичар Џозеф Луис Прус (1754-1826) почео је да изводи пажљиве експерименте који се односе на масе компонената одређених реакција.
На пример, елементи који чине воду су водоник и кисеоник. Проуст је открио да је у овој реакцији стварања воде водоник увек реаговао са кисеоником у константном и дефинисаном омјеру, који је био 1: 8. Погледајте како се ово догађа у наставку:

Приметићете да без обзира на масу елемената који се користе, пропорција ће увек бити иста.
Проуст је приметио да то није био случај само са водом, већ и са свим осталим супстанцама.
15,06 г бакар сулфида (ЦуС) настаје, на пример, реакцијом 10,00 г металног бакра (Цу) са 5,06 г сумпора (С). Дакле, ако удвостручимо количину бакра (која ће ићи на 20,0 г) и ако желимо да сав бакар реагује, такође ће бити потребно удвостручити количину сумпора, на 10,12 г, са укупним образовањем од 30,12 г сулфид.
Ако се дода количина која није пропорционална, вишак ће остати, неће реаговати. Напомена:
Не заустављај се сада... После оглашавања има још;)
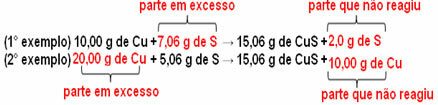
Приметићете да реакција се одвија само у складу са дефинисаним пропорцијама. Стога је Проуст 1799. закључио да, када се неколико супстанци комбинује у једињење, то се увек ради у дефинисаном односу масе.
Тако је створио Закон који се зове Прустов закон, Закон сталних пропорција или Закон дефинисаних пропорција, који се наводи на следећи начин:

Овај закон и Лавоисиеров закон (Закон о очувању масе) су именовани Закони о тежини, јер говоре у маси укључених супстанци.
Јеннифер Фогаца
Дипломирао хемију
Да ли бисте желели да се на овај текст упутите у школи или академском раду? Погледајте:
ФОГАЊА, Јеннифер Роцха Варгас. „Прустов закон или закон сталних пропорција“; Бразил Сцхоол. Може се наћи у: https://brasilescola.uol.com.br/quimica/lei-proust-ou-lei-das-proporcoes-constantes.htm. Приступљено 27. јуна 2021.