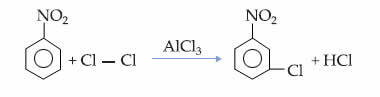
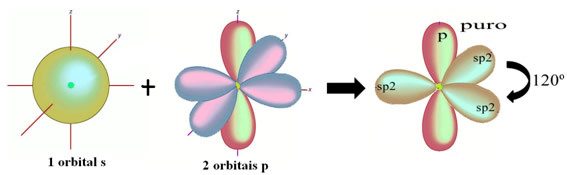
Хибридизација угљеника сп-типа2 јавља се када има двоструку везу и две једноструке везе или пи везу (π) и три сигма везе (σ). Заправо, сп хибридизација2 настаје између атома који успостављају двоструку везу.
Пример таквог молекула је формалдехид (ЦХ2О). Забележите његову структуру у наставку:
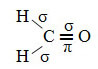
Као што се види у тексту "хибридизација сп типа3”, Хибридизација угљеника се дешава када електрон са поднивоа 2с прими енергију и„ транспортује се ”до 2п подниво и, према томе, потичу 4 хибридизоване орбитале из „мешавине“ атомских орбитала чиста.
У случају формалдехида, знамо да ће постојати пи веза, па је једна од ових хибридизованих орбитала резервисана за ову везу, док остале три изводе сигма везе:
Не заустављај се сада... После оглашавања има још;)
Атоми водоника који чине једноструку везу са угљеником чине је својом орбиталом:
Преостала "чиста" п-орбита двоструко веже атом кисеоника и молекул формалдехида следеће структуре:
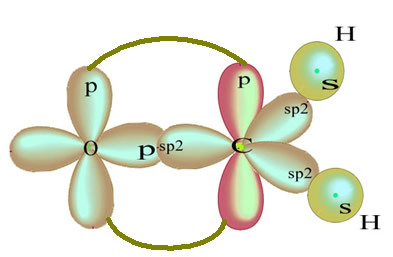
Што се тиче типа веза које постоје у овој формалдехидној структури, имамо:

Везе: 1 = 2 = σс-сп2
3 = σп-сп2
4 =πп-п
Јеннифер Фогаца
Дипломирао хемију
Да ли бисте желели да се на овај текст упутите у школи или академском раду? Погледајте:
ФОГАЊА, Јеннифер Роцха Варгас. „Сп2 хибридизација“; Бразил Сцхоол. Може се наћи у: https://brasilescola.uol.com.br/quimica/hibridizacao-tipo-sp2.htm. Приступљено 28. јуна 2021.