Нека једињења у својој структури имају двоструке везе које се смењују са једноструким везама. Најпознатији од свих је бензен, чију је структуру 1865. године предложио немачки хемичар Фриедрицх Аугуст Кекуле (1829-1896). Његова структура би била циклична и формирана би од три двоструке везе прошаране са три појединачне везе, као што је приказано на сликама испод:
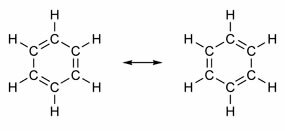
Оба начина представљања бензена су прихватљива, јер је могуће променити електроне у π везама без промене положаја атома. Међутим, нити представља тачно оно што јесте нити објашњава његово понашање. Требало би да се понаша као алкен и изазива реакције додавања, али у пракси се то не дешава. Бензен је прилично стабилан и понаша се као да нема двоструке везе; даје реакције супституције као код алкана.
Амерички научник Линус Паулинг 1930. године предложио је теорију резонанције која је објаснила ову очигледну контрадикцију. Ова теорија је рекла:
Не заустављај се сада... После оглашавања има још;)
„Кад год у структурној формули можемо променити положај електрона без промене положаја атома, стварна структура не неће бити ниједна од добијених структура, већ пре резонантни хибрид тих структура “.
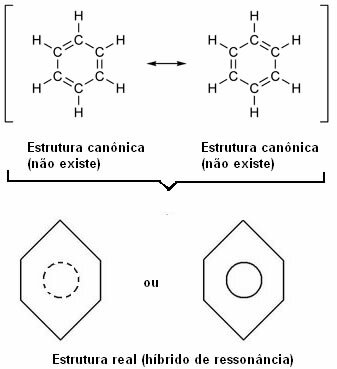
Овај ефекат доказује величина угљеничних веза и удаљеност између њих. Ова удаљеност је средња у односу на једноструку везу (1,54 А) и двоструку везу (1,34 А); која је, према томе, 1,39 А, због ефекта резонанце.
Овај ефекат се може видети и у структури молекула озона (О3), како је приказано испод:
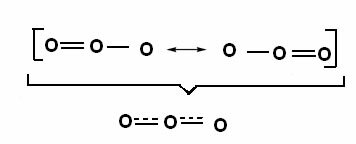
Канонске структуре и хибриди озонске резонанце.
Јеннифер Фогаца
Дипломирао хемију
Бразилски школски тим.
Да ли бисте желели да се на овај текст упутите у школи или академском раду? Погледајте:
ФОГАЊА, Јеннифер Роцха Варгас. „Резонанца у хемијским једињењима“; Бразил Сцхоол. Може се наћи у: https://brasilescola.uol.com.br/quimica/ressonancia-compostosquimicos.htm. Приступљено 28. јуна 2021.


