Метали су елементи које карактерише осветљеност, чврстоћа, топлотна и електрична проводљивост. Су применљиво у готово свим индустријским процесима, присутан у металним легурама које се користе у производњи алата, накита и кованог новца и у хемијским процесима као што је редокс, одговоран за рад стацкс и батерије.
У периодном систему су класификовани на:
семиметали
прелазних метала
алкални метали
земноалкални метали
У индустрији челика су подељени на:
црних метала
обојени метали
тешки метали
Прочитајте такође: Који су нови елементи периодног система?
Карактеристике метала

Они су углавном одлични проводници топлоте и електричне енергије.
Имају сјајни изглед.
имају високу густина.
Они су електропозитивни елементи (имају тенденцију да формирају катионе - позитивне наелектрисања).
Са изузетком Меркур, то су елементи са високом тачком топљења и чврсти на собној температури.
Имају механичку чврстоћу (жилавост).
Они су податни (могу се обликовати без ломљења).
Не заустављај се сада... После оглашавања има још;)
Метали периодног система
алкални метали
Да ли су елементи прва колона периодног система, породица 1А. Они се називају алкалним металима, јер када се помешају са водом, формирају хидроксиде, односно алкални (основни) раствор.
ти елементи који припадају овој групи су:
Литијум (ли)
Натријум (Ат)
Калијум (К)
Рубидијум (Рб)
Цезијум (Цс)
Францијум (Фр)
Електронска конфигурација алкалних метала у неутралном (ненаелектрисаном / јонизованом) стању је само присутна електрон у последњој љусци (валентни слој). О. атомски зрак а реактивност ових метала расте од врха до дна (посматрајући Периодни систем). Имају ниску тачку топљења у поређењу са другим металима, гипки су и нису врло густи, имају мат изглед због висок потенцијал оксидације.
Погледајте такође:Које су особине материје?
земноалкални метали
То су елементи који се појављују у друга колона периодног система, породица 2А. се зове земно алкална тежњом ка стварању раствора основног (алкалног) карактера и земљом јер су пре 19. века оксиди настали овим супстанцама били тако означени. Овај термин је коришћен за означавање нерастворљивих метала који нису подвргнути мутацији загревањем, заједничке карактеристике елемената групе 2. Касније, у светлу нових истраживања и експеримената, откривено је да су елементи „земље“ заправо оксиди који настају од метала.
Они су флексибилни метали, са малом густином два електрона у њеној спољној љусци, налазе се, у нормалним условима температуре и притиска, у чврстом стању. Припадајте овој групи:
Берилиј (Бе)
Магнезијум (Мг)
Калцијум (Овде)
Стронцијум (г.)
Баријум (Ба)
Радио (Жаба)
прелазних метала
чине група Б Периодног система, и налазе се између земноалкалних метала и метала. ИУПАЦ их је дефинисао као елементе који имају непотпуни енергетски подслој енергије. Термин "прелазних метала" се односи на прелазак из групе 2 у 13 у Периодном систему и све већи додатак електрона у ’д’ орбитали.
Прелазна метална група састављена је од густих елемената, са високим тачкама топљења и кључања, и мање реактивни од метала групе 1 и 2 (Породица 1А и 2А). Међу прелазним металима су волфрам који је елемент са највишом тачком топљења (3422 ° Ц) и жива (Хг) који је метал који је течан под нормалним условима температуре и притиска, његова тачка топљења је (-38,83 ° Ц).
Прелазни метали имају различита стања оксидације (НОКС променљива) и формирају обојене супстанце.

Елементи унутрашње транзиције
Елементи унутрашње транзиције су:
Лантаниди: серије састављене од елемената који имају од 57 до 71 протона и који су, изузев промета, природни.
Актиниди: група коју чине елементи у атомском броју од 89 до 103 и који су, углавном, синтетички. Све ове групе су радиоактивни са кратким полуживотом.
Елементи ове две групе имају високу тачку топљења и сви су чврсти на собној температури.
Полу метали
ти семиметали постоји, укупно, седам елемената:
Бор (Б)
Силицијум (Си)
Германијум (Ге)
Арсен (Ас)
Антимон (Пон)
Телур (Те)
Полониј (По)
Ова класификација је дата елементима који имају физичко-хемијске карактеристике релевантне за метале и такође друге значајне за неметалне елементе. Семиметали имају сјај, крхка су једињења, способни да формирају катионе, али и анионе (у зависности од стања), и посредни су проводници.
Врсте метала
Ферроус: супстанце које у свом саставу садрже гвожђе. Су легуре метала који садрже гвожђе као заједнички елемент, али се могу формулисати са различитим концентрацијама угљеник, на пример, или ковани различитим техникама, имајући тако производе са различитим физичким својствима.
Обојене: легуре настале другим врстама метала, као нпр алуминијум, бакар, никла, цинк, титан.
Тешки метали: олово, никл, цинк, жива. Они су реактивни, токсични и биоакумулативни метали. Користе се, између осталог, у батеријама, лампама, муницији за војне артефакте.
Хемијске везе метала
Метали су елементи електропозитивна, односно имају тенденцију да губе електроне у хемијској вези. Када метал ступи у интеракцију са неметалом, он извршити јонску везу због разлике у електронегативност. Друга могућност везивања за метале су металне везе.
У металне везе јављају се између метала, са делимичним ослобађањем електрона и стварањем облака или мора електрона око атома, што металним деловима гарантује својства проводљивости електрична и податност.
Погледајте такође: Проводници и изолатори - које су разлике?
Добијање метала
Већина метала се природно налази у стене и минерали повезани са другим елементима. Постоји неколико техника за рафинирање метала, попут електролизе и хемијских реакција на одвојена једињења.
У случају метала, две најчешће коришћене технике у индустријским размерама за постизање одређеног степена чистоће у металу су: разлика од густина и магнетна осетљивост (тенденција да метал мора да реагује на а магнетно поље).

решене вежбе
Питање 1 - (Енем) Кадмијум, присутан у батеријама, може доћи до тла када се ови материјали нерегуларно бацају у животну средину или када се спаљују. За разлику од металног облика, јони Цд2 + су изузетно опасни за тело јер могу да замене Јони Ца2 +, узрокујући дегенеративну болест у костима, чинећи их врло порозним и изазивајући јак бол у костима. зглобова. Такође могу инхибирати ензиме активиране катионом Зн2 +, који су изузетно важни за функционисање бубрега. На слици су приказане разлике у радијусу неких метала и њихових катиона.
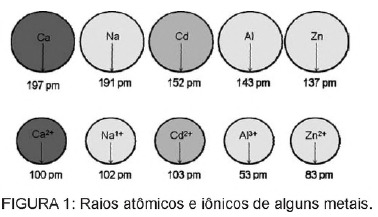
На основу текста, токсичност кадмијума у његовом јонском облику последица је овог елемента
А) представљају малу енергију јонизације, која фаворизује стварање јона и олакшава његово везивање за друга једињења.
Б) имају тенденцију да делују у биолошким процесима посредованим металним катионима са наелектрисањима у распону од +1 до +3.
В) имају радијус и наелектрисање релативно близу јона метала који делују на биолошке процесе, узрокујући сметње у тим процесима.
Д) имају велики јонски радијус, омогућавајући му да се умеша у биолошке процесе у којима мањи јони нормално учествују.
Е) имају +2 наелектрисање, што му омогућава да омета биолошке процесе у којима, нормално, учествују јони са нижим наелектрисањима.
Резолуција
Алтернатива Ц. Кадмијум је елемент сличан металним јонима које природно имамо у телу. Поред тога што се кадмијум биоакумулира, има сличност са металним групама, може се везати и за сулфхидрилне групе молекула протеина, узрокујући тако промене у биолошким процесима, као што је декалцификација, и уништавање ткива и црвених крвних зрнаца крв.
Питање 2 - За карактеристике релевантне за метале, означите нетачну алтернативу.
А) Већина метала су добри електрични и топлотни проводници.
Б) Неки метали су подложни оксидацији и / или редукцији.
В) Гвожђе је отпоран и ковљив метал, односно лако се обликује.
Д) Земноалкалијски метали имају овај назив „земља“ који се односи на оксиде ових метала, који су тамне боје.
Е) Метали су елементи различитих боја и мутни, услед дејства оксидације.
Резолуција
Алтернатива Е. Метали су природно сјајни и металне боје, могу проћи оксидацију, што узрокује промене карактеристика релевантних за аспект дела, али ово није појава која се дешава код свих метала, ау неким случајевима оксидација зависи од неколико фактора спољни.
аутор Лаиса Бернардес
Наставник хемије

