О. принцип Ле Цхателиер-а говори нам да ће се, када је поремећај узрокован систему у равнотежи, померити у смеру који минимализује силе створене тим поремећајем и успоставља нову хемијску равнотежу.
Једно од ових поремећаја је варијација температуре. Ова варијација је важна јер ће, осим што ће изазвати помак равнотеже, променити и вредност константе равнотеже, Кц.
Да бисте боље разумели како се то догађа, погледајмо пример:
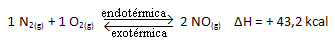
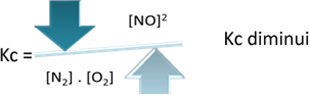
К.ц = _ [НА]2___
[Н2]. [О.2]
Горња реакција се јавља у директном смеру са апсорпцијом енергије, она је ендотермна. Обрнути процес се, с друге стране, дешава са ослобађањем енергије, што је егзотермна реакција.
Дакле, ако повећамо температуру система, хемијска равнотежа ће се померити ка ендотермној реакцији, која је у овој реакцији десно. То је тако да се топлота апсорбује и успостави равнотежа.
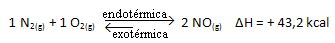
Тачно је и супротно; ако смањимо температуру овог система, реакција ће се померити у смеру да ће ослободити топлоту, јер ће се укупна енергија реакције смањити. То значи да ће се равнотежа померити ка егзотермној реакцији, која је у овом случају лево:
Не заустављај се сада... После оглашавања има још;)
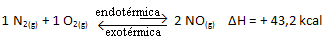
Укратко:

У односу на константу равнотеже (Кц), када се температура повећава, фаворизује ендотермну реакцију и више НО(г) настаје повећавајући његову концентрацију и смањујући концентрацију реактаната. Приметите у доњој формули да је концентрација НО(г) је директно пропорционалан константи К.ц, стога се такође повећава:
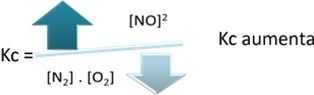
Али ако смањимо температуру, преусмеравајући реакцију ка егзотермној реакцији, концентрација НО производа ће се смањити, а концентрације реактаната ће се повећати. Пошто су концентрације реактаната обрнуто пропорционалне константи Кц, тада ће се смањивати:
Јеннифер Фогаца
Дипломирао хемију
Да ли бисте желели да се на овај текст упутите у школи или у академском раду? Погледајте:
ФОГАЊА, Јеннифер Роцха Варгас. „Варијације температуре и померање хемијске равнотеже“; Бразил Сцхоол. Може се наћи у: https://brasilescola.uol.com.br/quimica/variacao-temperatura-deslocamento-equilibrio-quimico.htm. Приступљено 28. јуна 2021.
Хемија

Проверите своје знање и научите више помоћу ове листе решених вежби на хемијским вагама. Кроз овај материјал моћи ћете боље да разумете како се раде константе равнотеже (Кп, Кц и Ки), померање равнотеже, пХ и пОХ, као и равнотежа у такозваним пуферским растворима.


