Електролиза је физичко-хемијски процес који користи електричну енергију из било ког извора (као што је батерија или батерија) да присили појаву хемијске реакције да би произвела једноставне или композитне супстанце које се у природи не могу наћи или их нема у великим количинама.
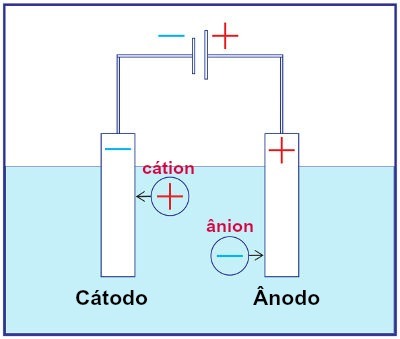
Приказ склопа било ког система за електролизу
Током електролизе, катјон се подвргава редукцији на катоди, а анион оксидацији на аноди. То се дешава електричним пражњењем које обезбеђује спољни извор. Тако у електролизи имамо не-спонтану реакцију оксидације и редукције.
Сада схватите два начина на која се јавља електролиза:
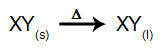
У овој врсти електролизе користимо а јонска супстанца у течном стању у електролитској посуди. Када се јонска супстанца (КСИ) подвргне фузији, она пролази кроз процес дисоцијација, као што је представљено у наставку:

Затим, када је извор напајања укључен, катион (Кс+) креће се према катоди, а аниони (И-) кретати се према аноди. Тиме:
На катоди: катиони примају електроне (подвргавају се редукцији) и трансформишу се у стабилну супстанцу (Кс), процес представљен следећом једначином:
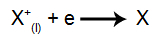
На аноди: аниони губе електроне (подвргавају се оксидацији) и постају стабилна супстанца (Кс), процес представљен следећом једначином:

а) Пример магматске електролизе
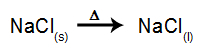
Као пример, следите сада магматску електролизу натријум хлорид (НаЦл). Када се натријум хлорид (НаЦл) подвргне фузији, он пролази кроз процес дисоцијације, као што је приказано доле:
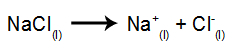
Затим, када је извор напајања укључен, катион (На+) креће се према катоди, а аниони (Цл-) кретати се према аноди. Тиме:
На катоди: катиони у+ они примају електроне (подвргавају се редукцији) и постају стабилна супстанца (На, који је чврсти метал), процес представљен једначином доле:

На аноди: ањони Цл- губе електроне (подвргавају се оксидацији) и постају стабилна супстанца (Цл2, који је гасовит), процес представљен једначином испод:

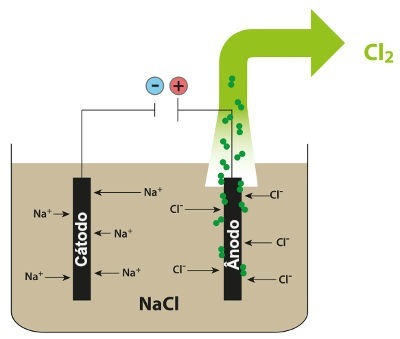
Шема која приказује магматску електролизу НаЦл
Дакле, у магматској електролизи натријум-хлорида имамо стварање металног натријума (На) и гасовитог хлора (Цл2).
У овој врсти електролизе користимо јонску супстанцу растворену у води, унутар електролитског резервоара. Дакле, пре извођења електролизе прво помешамо супстанцу (обично сол неоргански) у води да би проузроковао његову дисоцијацију (ослобађање катјона и аниона), као што је приказано доле:
Не заустављај се сада... После оглашавања има још;)
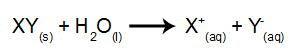
Разлика у односу на магматску електролизу је у томе што поред јона из дисоцијације имамо и јоне из самојонизације воде. У својој самојонизацији, вода ствара хидронијум-катион (Х+) и хидроксид анион (ОХ-), као у доњој једначини:

Дакле, унутар електролитске посуде имамо два катиона (један из супстанце јонски и један из воде) и два аниона (један из јонске супстанце, а други из Вода).
Да бисмо знали који ће се катион преместити на катоду, а који анион на аноду, потребно је знати редослед пражњења катионова и аниона.
За катионе:
Ау> Пт> Хг> Аг> Цу> Ни> Цд> Пб> Фе> Зн> Мн> хидронијум> ИИИА породица> ИИА породица> ИА породица
за анионе
Неоксигенирани ањони и ХСО4 > хидроксид> кисеонични аниони и Ф.
Затим, када је извор напајања укључен, катион (Кс+) креће се према катоди, а један од ањона (И-) креће се према аноди.
На катоди: катиони примају електроне (подвргавају се редукцији) и трансформишу се у стабилну супстанцу (Кс), процес представљен једначином доле:

На аноди: аниони губе електроне (подвргавају се оксидацији) и претварају се у стабилну супстанцу (И), процес који представља једначина испод:
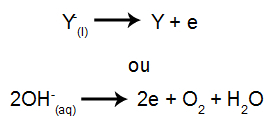
а) Пример водене електролизе
Као пример користићемо водену електролизу натријум хлорида (НаЦл). Када се натријум хлорид (НаЦл) раствори у води, он пролази кроз процес дисоцијације, као што је приказано доле:
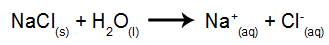
Поред дисоцијације НаЦл, имамо и самојонизацију воде:

Дакле, имамо Х катионе+ и на+ и ОХ ањони- и Цл-. Тада, када је извор напајања укључен, имамо следеће:
на катоди: Х катиони+ примају електроне (редуковане) и постају стабилна супстанца (Х.2, који је гас). То је зато што хидронијум има приоритет испуштања над елементима породице ИА (у овом случају На). Процес је представљен једначином у наставку:
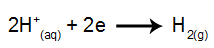
на аноди: ањони Цл- губе електроне (подвргавају се оксидацији) и постају стабилна супстанца (Цл2, који је гасовит). То је зато што Цл- он је неоксигенирани анион и има приоритет пражњења над хидроксидом, процес представљен једначином доле:


Шема која приказује водену електролизу НаЦл
Дакле, у воденој електролизи натријум-хлорида имамо стварање водоник-гаса (Х2) и гасовити хлор (Цл2).
Ја сам, Диого Лопес Диас
Хемија

Примена електролизе, галванизације, никловања, хромирања, никла, хрома, катоде, натријума, алуминијума, хлора, каустична сода, гас водоник, магматска електролиза, водена електролиза, алкални метали, земноалкална земља, гас хлор.
