ТХЕ енталпија формације, такође зван стандардна енталпија формације, или стандардна топлота формирања, је прорачун топлоте која се ослобађа или апсорбује при формирању 1 мола супстанце из једноставних супстанци, у стандардном стању.
Немогуће је израчунати апсолутну вредност енталпија сваке супстанце, али је могуће израчунати варијацију енталпије која се јавља у реакцији помоћу калориметра.
Неопходно је то упамтити договорено је да се за једноставне супстанце у стандардном стању усвоји вредност енталпије једнака нули. Дакле, ако желимо да сазнамо шта је енталпија формирања супстанце, само треба да знамо вредност енталпије реакције њеног формирања из једноставних супстанци.
На пример, желимо да пронађемо енталпију од 18 грама воде, што одговара 1 мол, с обзиром да је његова моларна маса 18 г / мол. Да бисмо то урадили, прво нам је потребна реакција да бисмо формирали воду из једноставних супстанци, као што је приказано доле:
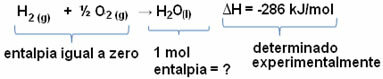
Имајте на уму да је вредност промене енталпије која се догодила у овој реакцији експериментално одређена помоћу калориметра и једнака је -286 кЈ / мол.
Формула која израчунава ову промену енталпије (ΔХ) је:
ΔХ = ХПроизводи - ХРеагенси
Дакле, пошто већ знамо вредност ΔХ и да је енталпија реактаната једнака нули (пошто су у стандардном стању једноставне супстанце), онда можемо закључити да је енталпијска вредност 1 мол воде једнака енталпијској промени формационе реакције, јер је једини производ те реакције, као што је приказано доле:
ΔХ = ХПроизводи - ХРеагенси
-286 кЈ / мол = Х.Х2О - (ХХ2 + Х1/2 О.2)
-286 кЈ / мол = ХХ2О - 0
Х.Х2О = - 286 кЈ / мол
Ова врста енталпије, постигнута енталпијом једноставних супстанци у стандардном стању, је према томе стандардна енталпија формације (ΔХ0).
Сада постоји много супстанци које се не формирају директно једном реакцијом, попут воде. У таквим случајевима, енталпија формације може се израчунати на основу варијације енталпије реакције.
На пример, НХ4Цл настаје следећом реакцијом:
НХ3 + ХЦл → НХ4Кл ΔХ = -176 кЈ / мол
Имајте на уму да ниједан од реактаната није једноставна супстанца, па им не можемо доделити енталпију од нуле. Морамо знати енталпије формирања сваког од реагенаса, јер они настају реакцијама између једноставних супстанци:
НХ3: ΔХ = -46 кЈ / мол
ХЦл: ΔХ = -92,4 кЈ / мол
Додавањем ове две енталпије добијамо вредност енталпије реактаната и можемо наћи енталпију НХ4Цл:
Х.Р. = ХНХ3 + ХХЦл
Х.Р. = (-46 + (-92,4) кЈ / мол)
Х.Р. = -138,4 кЈ / мол
Заменом у формули:
ΔХ = ХПроизводи - ХРеагенси
-176 = Х.НХ4Цл - ( -138,4)
Х.НХ4Цл = - 176 - 138,4
Х.НХ4Цл = -314,4 кЈ / мол
У овом случају смо директно сумирали вредности енталпија настајања реактаната, јер је однос реакције био само 1 мол. Међутим, ако је у другим реакцијама количина молова различита, биће потребно прво помножити енталпију стварања реактанта са бројем молова.
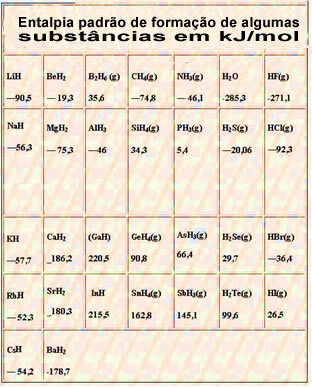
Испод је табела са стандардном енталпијом формирања неких супстанци на 25 ° Ц и 1 атм:
Јеннифер Фогаца
Дипломирао хемију
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/quimica/entalpia-formacao.htm

