У Међумолекуларне снаге су тема из хемије која се сигурно може појавити на националном испиту за средњу школу (И било). Стога је вредно погледати главни садржај ове теме у овом чланку.
Дефиниција
Међумолекуларне снаге то су силе - различитог интензитета (слабе, средње или јаке) - електростатичке привлачности или везе успостављене између молекула супстанце које одржавају заједницу између њих.
Врсте интермолекуларних сила
Тхе) Индуковани дипол
И интермолекуларна сила која се јавља између молекула супстанце са неполарном карактеристиком. То се дешава, на пример, између молекула супстанци попут О.2, Х2, не2, ЦО2, ЦХ4.
Унија између ових молекула настаје када се између њих створи дипол. То се дешава када електрони из једног молекула померају електроне из другог, стварајући тако негативни и позитивни пол, који се преноси са једног молекула на други.
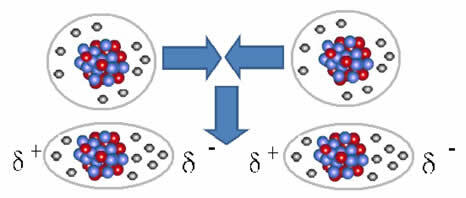
Приказ формирања дипола у неполарним молекулима
Између ових молекула формирана су два пола, а негативни пол једног ступа у интеракцију са позитивним половом другог. Пошто су ови полови створени, реч је о интермолекуларној сили ниског интензитета.
Б) стални дипол
И интермолекуларна сила који се јавља између молекула супстанце са поларном карактеристиком. Примери су молекули супстанци као што су ХЦН, Х.2О, НХ3, ЦО, ЦХ3Кл.
Унија између ових молекула се дешава када негативни пол једног ступи у интеракцију са позитивним половом другог.
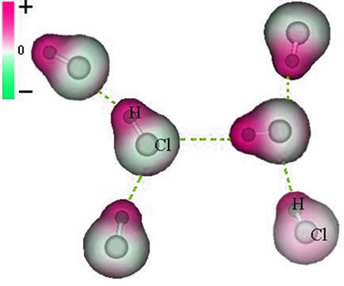
Приказ трајне диполне силе између молекула ХЦл
Како полови већ постоје, трајна диполна интермолекуларна сила је већег интензитета од индукованог дипола.
ц) водоничне везе
То интермолекуларна сила јавља се између поларних молекула који имају атом водоника везан директно за атом кисеоника, азота или флуора.
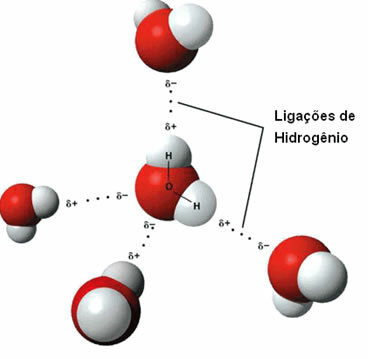
Приказ водоничних веза између молекула воде
Водонична веза настаје када водоник у једном молекулу ступи у интеракцију са кисеоником, азотом или флуором у другом молекулу.
г) диполни јон
Ова интермолекуларна сила се јавља између поларног молекула који има пар невезујућих електрона и јона (катион или анион) у раствору.
На пример, молекул воде има два пара невезујућих електрона у кисеонику. Ако у воденој средини има јона, они се приближавају молекулу воде, пошто у њему постоје полови.
Не заустављај се сада... После оглашавања има још;)
Значај
Значај познавања интермолекуларне силе за Енем то је разумевање које они доносе у вези са физичким стањима, тачком топљења, тачком кључања и растворљивошћу супстанци.
Тхе) Однос са тачком топљења и кључања супстанце
Тачка топљења означава температуру преласка из чврстог у течно стање, а тачка кључања температуру преласка из течног у гасовито стање.
Овај пасус је директно повезан са интеракцијом између молекула супстанце, јер оно што разликује једно физичко стање од другог је ниво агрегације између његових молекула.
Дакле, што је интермолекуларна сила интензивнија, тачке топљења и кључања су веће. Што су интермолекуларне силе мање интензивне, тачке топљења и кључања су ниже. Тако можемо дефинисати силазни редослед тачке топљења и кључања:
Водонична веза> трајни дипол> индуковани дипол
Б) Однос према растворљивости
Генерално, морамо знати да се слично раствара слично, односно поларна супстанца раствара поларну супстанцу, а неполарна супстанца раствара неполарну супстанцу.
Међутим, још увек постоји могућност интеракције између молекула растворене супстанце и молекула растварача. То се дешава само ако је ова нова интеракција већа од онога што већ постоји између молекула саме супстанце.
Пример примене интермолекуларне силе у Енем-у
1. пример: (Енем-2011) Људска кожа када је добро хидратизована добија добру еластичност и мекан и гладак изглед. С друге стране, када је суво, губи еластичност и делује непрозирно и храпаво. Да бисте спречили исушивање коже, неопходно је, кад год је то могуће, користити хидратантне хидратантне креме, углавном направљене од глицерина и полиетилен гликола:

Задржавање воде на површини коже коју промовишу хидратантне креме последица је интеракције хидроксилних група средстава за влажење са влагом која се налази у животној средини кроз:
а) јонске везе
б) Лондонске снаге
в) ковалентне везе
г) дипол-дипол силе
д) водоничне везе
Одговор на ово питање је водонична веза, јер је молекул воде водоник везан за атом кисеоника. Исто се дешава са молекулима пропилен гликола и полиетилен гликола, што је повољан услов за настанак ове врсте интермолекуларне силе.
Ја сам, Диого Лопес Диас
Да ли бисте желели да се на овај текст упутите у школи или академском раду? Погледајте:
ДАНИ, Диого Лопес. „Интермолекуларне силе у непријатељу“; Бразил Сцхоол. Може се наћи у: https://brasilescola.uol.com.br/quimica/forca-intermoleculares-no-enem.htm. Приступљено 27. јуна 2021.