“Хемијска веза “био је израз који је Гилберт Невтон Левис први пут употребио 1920. године у чланку да објасни зашто да се атоми држе заједно да би створили супстанце и такође зашто се држе заједно на хиљаде година стар.
Атоми већине хемијских елемената који су до тада били познати и наведени у Периодном систему не појављују се у изолованом облику у природи. Већина материјала присутних у нашем свакодневном животу су супстанце које могу бити једноставне (састоје се од атома само једне врсте хемијских елемената) или композити (имају атоме два или више хемијских елемената многи различити).
То је зато што атоми имају способност да праве хемијске везе са другим атомима, који могу бити исти елемент или различити елементи. Те везе су толико јаке да ће атоми без икаквог спољног утицаја у већини случајева остати спојени такви какви јесу.
Мапа ума: Хемијске везе

* Да бисте преузели мапу ума у ПДФ-у, Кликните овде!
На пример, није уобичајено да у природи налазимо слободан атом кисеоника; међутим, налазимо неколико супстанци у којима се чини да је везан за друге атоме. Пример једноставне супстанце је гас кисеоник у коме је сваки молекул састављен од два везана атома кисеоника (О
2); док је пример композитне супстанце вода, где сваки молекул има два атома водоника везана за атом кисеоника (Х2О).Једини елементи који се у природи могу наћи стабилно изоловани су племените гасове, односно елементи породице 18 Периодног система (Хе, Не, Ар, Кр, Ксе и Рн). Свим овим елементима заједничка је чињеница да у последњој електронској љусци (валентном слоју) имају осам електрона, са изузетком хелијума (Хе), која има само једну електронску љуску (К слој) и због тога садржи два електрона, што је максимални могући број електрона у тој слој.
Тако је Гилберт Н. Левис и такође научник Ватер Коссел дошли су до закључка да атоми осталих елемената везују се за осам електрона (или два, ако имате само К љуску) и тако се стабилизују. Тада је створена електронска теорија валенције, што указује на то колико хемијских веза ствара атом елемента, на основу објашњене идеје.
Стога, атоми стварају хемијске везе, настојећи да изгубе, стекну или деле валентне електроне љуске док не достигну конфигурацију следећег племенитог гаса.Ова теорија такође се позвала правило октета.
На пример, кисеоник је двовалентан јер у својој валентној љусци има шест електрона. Због тога је потребно да прими још два електрона да би имао конфигурацију неона племенитог гаса (Не), односно са осам електрона у валентној љусци, што је у овом случају Л шкољка. У случају поменутих гасова кисеоника и воде имамо следеће:
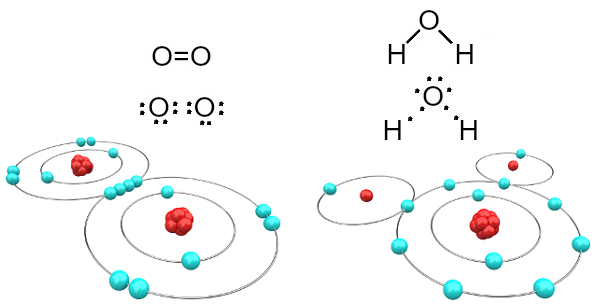
Молекули кисеоника и воде настали ковалентним везама
Имајте на уму да је у првом случају (гас кисеоник - О2), сваки атом кисеоника дели два електрона, од којих оба имају по осам електрона у валентној љусци. То значи да а двострука веза (две везе истовремено између два атома).
У случају воде, сваки од два атома водоника дели електрон са централним атомом кисеоника и сви су стабилни (кисеоник има осам електрона у валентној љусци, а сваки водоник има два електрони). Овде се остварују и две једноставне везе.
Ова врста хемијске везе, у којој сви атоми требају да приме електроне (водоник, неметали и полуметал) и у којој се електрони деле у паровима, назива се ковалентна веза.
Али постоје још две врсте хемијских веза:
(1) јонска веза → постоји дефинитиван пренос електрона са једног атома на други. Ова врста везе се јавља између атома метала (који имају тенденцију да губе електроне да би остали стабилни) и атоми водоника, неметали и полу метали (који имају тенденцију да добијају електроне да би остали стабилно).
Пример је натријум хлорид (НаЦл - кухињска со), где је натријум метал који има тенденцију да губи електрон, док је хлор неметал који има тенденцију да добија електрон. Дакле, натријум донира(Црвена стрелица)електрон до хлора, формирајући сол, врло стабилну супстанцу. Пошто дипломирају (Црна стрела) јони, који су хемијске врсте са супротним наелектрисањима (+ и -), један јон привлачи други у близини и јонски кластери настају са огромним бројем јона, као и кристали у кухињској соли.

Стварање натријум хлорида јонским везивањем
(2) Метални прикључак → Теорија је да метали (попут алуминијума, злата, сребра, бакра, итд.) Настају кластером неутронских атома и катиони које држи заједно нека врста „облака“ слободних електрона (електрона који су изгубљени у формирању катиона навео). Овај облак (или море) електрона деловао би као метална веза која би држала атоме на окупу.
За више детаља о овим врстама хемијских веза, као и о правилу октета, прочитајте повезане чланке у наставку.
Мапа ума М.е Вицтор Рицардо Феррреира
Наставник хемије
Јеннифер Фогаца
Дипломирао хемију
Извор: Бразил Сцхоол - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-uma-ligacao-quimica.htm



