Гас и пара
Разлика између гаса и паре дата је из критичне температуре. Пара је материја у гасовитом стању, стање које се може повећати течност са растућим притиском. Бензин није исто. То је течност која се не може укапити једноставним повећањем притиска. Због тога се гас разликује од паре.
Понашање гасова
Дата супстанца у гасовитом стању је гас ако је њена температура виша од критичне температуре, ако је температура једнака или нижа од критичне температуре супстанца је пара.
Прави гасови које обично познајемо, попут хелијума, азота и кисеоника, имају различите и посебне молекуларне карактеристике сваког од њих. Међутим, ако их све ставимо на високе температуре и ниске притиске, почињу да показују врло слично понашање. У проучавању гасова усвојен је једноставан теоријски модел, који у пракси не постоји, са понашањем сличним понашању стварних гасова. Ова апроксимација постаје боља што су нижи притисак и виша температура. Овај модел гаса је тзв савршен гас.
Око 17. и 19. века три научника (Јацкуес Цхарлес, Лоуис Ј. Гаи-Луссац и Паул Е. Цлаиперон), након проучавања понашања гасова, разрадио законе који регулишу понашање савршених гасова, такође названих идеалним гасовима. Закони које су они одредили успостављају правила о „спољном“ понашању савршеног гаса, што доводи до броји само физичке величине које су са њима повезане, а то су: запремина, температура и притиска.
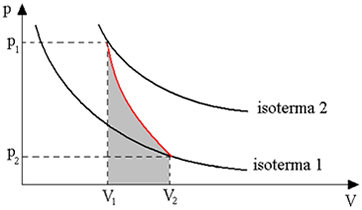
Општи закон савршених гасова
Израз који одређује општи закон за савршене гасове може се видети на следећи начин:
Не заустављај се сада... После оглашавања има још;)
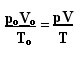
где је стрО., В.О. и тО. то су почетни притисак, почетна запремина и почетна температура. Ово је израз који се користи када варијабле гаса варирају.
бојлов закон
Роберт Боиле, физичар и хемичар, био је тај који је одредио закон који регулише трансформације гаса када се његова температура одржава константном. Његов закон каже да када је гас подвргнут изотермичкој трансформацији, његов притисак је обрнуто пропорционалан заузетој запремини. Из овог закона сазнајемо како Т.О. = Т Морамо да:
П.О.В.О. = пВ
Цхарлесов закон
Чарлсов закон је закон који управља трансформацијама савршеног гаса у константну запремину. Ове трансформације називају се изохорне или изометријске трансформације. Према овом закону, када савршена гасовита маса прође изохорну трансформацију, њен притисак је директно пропорционалан апсолутној температури. Математички се овај закон може изразити на следећи начин:

где је стрО. и тО. су почетни притисак и почетна температура.
Гаи-Луссац-ов закон
Гаи-Луссац-ов закон је закон који регулише трансформације савршеног гаса под сталним притиском. Овај закон, упркос томе што носи име Гаи-Луссац, већ је открио физичар и хемичар А.Ц.Цхарлс. Према закону, када гас пролази кроз изобарну трансформацију, запремина гаса је директно пропорционална његовој апсолутној температури. Математички се овај закон може изразити на следећи начин:

Где В.О. и тО. одговарају почетној запремини и почетној температури.
Аутор Марко Аурелио да Силва
Види више!!
Трансформације гаса
Знајте шта су трансформације гаса.
Да ли бисте желели да се на овај текст упутите у школи или академском раду? Погледајте:
САНТОС, Марко Аурелијо да Силва. „Проучавање гасова“; Бразил Сцхоол. Може се наћи у: https://brasilescola.uol.com.br/fisica/estudo-dos-gases.htm. Приступљено 27. јуна 2021.