Као што је објашњено у тексту Засићење решења, хемијски раствори настају растварањем а раствор на а растварач. Свака растворена супстанца има коефицијент растворљивости специфична, што је максимална количина растворене супстанце која се раствара у датој количини растварача у датом тренутку температура.
Изградња графа са кривом растворљивости
На пример, коефицијент растворљивости КНО-а3 је 31,2 г у 100 г воде на 20 ° Ц. Ако тачно ту количину калијум нитрата растворимо у 100 г воде на 20 ° Ц, засићеном раствору. Свака додатна количина ове соли ће се исталожити (формира дно тела у контејнеру).

Међутим, коефицијент растворљивости варира у зависности од температуре. Дакле, ако загревамо овај засићени раствор са доњим делом КНО3, талог ће се постепено растварати у води. Видети испод вредности коефицијената растворљивости КНО3 у 100 г воде на различитим температурама:
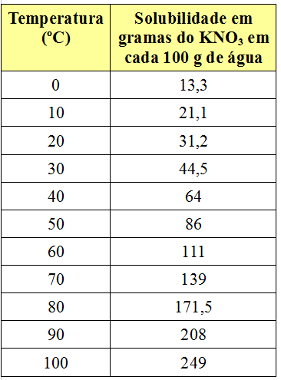
Имајте на уму да растворљивост ове соли у води се повећава са порастом температуре. У већини супстанци то је такође случај. Ако ове вредности ставимо у а
графика, имаћемо следеће: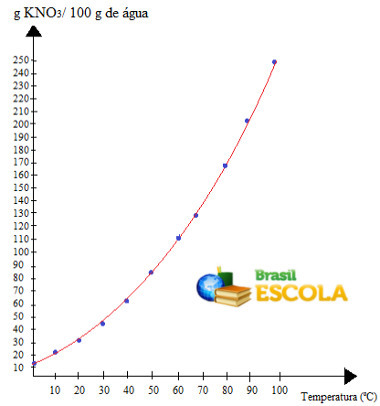
ово је позив крива растворљивости КНО-а3. Кажемо да је узлазно јер расте са порастом температуре.
Карактеристике кривих растворљивости растворених супстанци у графикону
Свака супстанца има своје крива растворљивости за дати растварач. Неке од ових супстанци имају смањену растворљивост са порастом температуре, као што је случај са ЦаЦрО4, који имају крива растворљивости надоле. То значи да ако загрејемо засићени раствор те соли, део растворене соли ће се исталожити.
Што се тиче осталих супстанци, пораст температуре не омета толико растворљивост, као што се дешава са раствором кухињске соли (НаЦл). На 20 ° Ц, коефицијент растворљивости НаЦл је 36 г у 100 г воде, али ако температуру повећамо на 100 ° Ц, та растворљивост ће се повећати само на 39,8 г, што је врло мало.
Не заустављај се сада... После оглашавања има још;)
Постоје и супстанце у којима се растворљивост само повећава до одређене тачке пораста температуре, јер се након тога растворљивост смањује. То се дешава, на пример, са хидратисаним супстанцама, које загревањем достигну време када дехидрирају. Стога, како се његов састав мења, тако се мења и његова растворљивост у зависности од температуре. Ова појава се може посматрати на графикону кроз флексије у криви растворљивости.
У наставку представљамо а графикон са кривима растворљивости различитих супстанци:
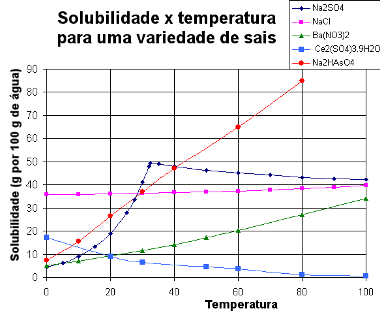
Криве растворљивости различитих соли
Кроз ову врсту графикона можемо упоредити растворљивости различитих соли у истом растварачу и на истим температурама.
Класификација раствора помоћу графикона са кривом растворљивости
У криве растворљивости они такође помажу у одређивању засићености раствора, односно да ли су незасићена, засићена, засићена у позадини или презасићена. Погледајте пример:
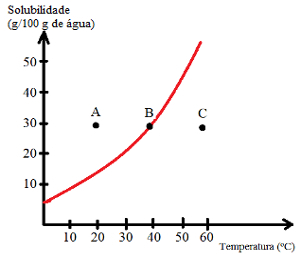
Погледајте које су врсте решења означене тачкама А, Б и Ц:
О: Засићен доњим делом тела. У тачки А, 30 г растворене супстанце се раствори у 100 г воде на 20 ° Ц. Крива показује да је у овом тренутку коефицијент растворљивости око 15 г / 100 г воде. Дакле, како је количина присутне растворене супстанце већа, добија се засићени раствор са дном тела.
Б: Засићен. Тачка Б се налази тачно на кривој растворљивости, што указује на то да је раствор засићен, јер се 30 г растворене супстанце раствара у 100 г воде на 40 ° Ц. То је, дакле, тачно коефицијент растворљивости овог раствореног средства на овој температури.
Ц: Незасићени. Постоји 30 г растворене супстанце растворене у 100 г воде на 60 ° Ц. Крива показује да је у овом тренутку коефицијент растворљивости већи од 50 г / 100 г воде. Дакле, како је количина растворене растворене супстанце мања од коефицијента растворљивости, постоји незасићени раствор.
Према томе, можемо закључити да:
Тачке изнад кривине: засићена решења са позадинским телом;
Тачке на кривој: засићена решења;
Тачке испод криве: незасићена решења.
Јеннифер Фогаца
Дипломирао хемију
Да ли бисте желели да се на овај текст упутите у школи или академском раду? Погледајте:
ФОГАЊА, Јеннифер Роцха Варгас. „Графикони кривих растворљивости“; Бразил Сцхоол. Може се наћи у: https://brasilescola.uol.com.br/quimica/graficos-das-curvas-solubilidade.htm. Приступљено 28. јуна 2021.
Хемија

Дисоцијација и јонизација, италијански научник Волта, електрична струја, шведски физички хемичар Свант Аугуст Аррхениус, теорија Аррениус, позитивни јони, катиони, негативни јони, аниони, каустична сода, кухињска со, поларни молекули, дисоцијација јонски,

