ТХЕ ПрвиЗакондајеТермодинамика је апликација принципдајеконзервацијадајеенергије за термодинамичке системе. Према овом закону, варијација унутрашња енергија термодинамичког система је разлика између количине топлота апсорбован системом и радом који је он обавио.
Гледајтакође:Основни појмови и резиме термологије
Шта је први закон термодинамике?
Први закон термодинамике је директна последица принципа очувања енергије. Према овом принципу, укупна енергија системаувек остаје константа, пошто она није изгубљена, већ трансформисана.
У оквиру Термодинамика, се користе конкретнији појмови и мање генерички од оних који се користе у принципу очувања енергије. У Првом закону термодинамике користимо концепте попут енергијеинтерно,топлота и радити, који су релевантни за делокруг Термичке машине (технолошке примене од фундаменталног значаја за термодинамику).

Замислите машину на парни погон, када радни флуид те машине (водена пара) прима топлоту из спољног извора, могуће су две конверзије енергије: пара може имати сопствену
температура повећана за неколико степени или, чак, може проширити и померите клипове те машине, извршавајући на тај начин одређену количину радити.„Варијација унутрашње енергије термодинамичког система одговара разлици између количине топлоте коју он апсорбује и количине посла који овај систем обавља.
Не заустављај се сада... После оглашавања има још;)
Формула првог закона термодинамике
Формула која се користи за математички опис Првог закона термодинамике приказана је у наставку:

У - унутрашња варијација енергије (кал или Ј)
К - топлота (креч или Ј)
τ - рад (креч или Ј)
Да бисмо користили ову формулу, морамо обратити пажњу на нека сигнална правила:
ΔУ - биће позитивно ако се температура система повећа;
ΔУ - биће негативан ако се температура система смањи;
К - биће позитивно ако систем апсорбује топлоту из спољне околине;
К - биће негативно ако систем даје топлоту спољном окружењу;
τ – биће позитивно ако се систем прошири радећи на спољном окружењу;
τ – биће негативно ако се систем уговара, примајући посао из спољног окружења.
унутрашње варијације енергије
Израз ΔУ односи се на енергетску промену која се приписује кинетичке енергије саставних честица система, у случају идеалног гаса, може се рећи да је ΔУ еквивалентан:
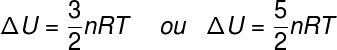
не - број молова (мол)
Р. - универзална константа идеалних гасова (0,082 атм.л / мол. К или 8,31 Ј / мол. К)
Т. - апсолутна температура (келвин)
Анализирајући формуле, може се видети да, ако у систему нема промене температуре, његова унутрашња енергија такође ће остати непромењена. Даље, важно је рећи да за термичке машине које раде у циклусима, варијација унутрашње енергије на крају сваког циклуса мора бити нула, јер се у том тренутку мотор враћа у рад са почетном температуром.
Гледајтакође:Перформансе термичких машина: како се израчунава?
Топлота
Прелазећи на следећи термин, К, који се односи на количину топлоте која се преноси у систем, обично користимо фундаментална једначина калориметрије, приказано испод:
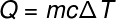
К -грејача (креч или Ј)
м - маса (г или кг)
ц - специфична топлота (кал / гºЦ или Ј / кг. К)
ΔТ - варијација температуре (Целзијус или Келвин)
Посао
Последња од величина повезаних са Првим законом термодинамике је рад (τ), који има а аналитичка формула само за трансформације које се дешавају под сталним притиском, такође позната као изобарске трансформације, гледати:
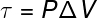
П. - притисак (Па или атм)
ΔВ - варијација запремине (м³ или л)
Када притисак који се врши на систем није сталан, рад се може израчунати површином графикона притиска у односу на запремину (П к В). Да бисте сазнали више о овој скаларној величини, посетите: радити.
решене вежбе
Питање 1)(ЦефетМГ) Посао изведен у затвореном термичком циклусу једнак је 100 Ј, а топлота укључена у размену топлоте једнака је 1000 Ј, односно 900 Ј, са топлим и хладним изворима.
Из Првог закона термодинамике, варијација унутрашње енергије у овом термичком циклусу, у џулима, је
а) 0
б) 100
ц) 800
г) 900
д) 1000
Резолуција
Алтернатива а.
Решимо вежбу користећи Први закон термодинамике, имајте на уму:

Према изјави, од нас се тражи да израчунамо варијацију унутрашње енергије у затвореном термодинамичком циклусу, у ком случају знамо да је унутрашња варијација енергије мора бити нула, јер ће се машина вратити у рад на истој температури као на почетку циклуса.
Питање 2)(Упф) Узорак идеалног гаса шири се удвостручавањем запремине током изобарске и адијабатске трансформације. Узимајући у обзир да је притисак који гас искуси 5.106 Па и његова почетна запремина 2.10-5 м³, можемо рећи:
а) Топлина коју гас апсорбује током процеса износи 25 кал.
б) Рад гаса током његовог ширења је 100 кал.
в) Унутрашња енергетска варијација гаса је –100 Ј.
д) Температура гаса остаје константна.
е) Ништа од наведеног.
Резолуција
Алтернатива ц.
Користећи информације дане у изјави о вежби, користићемо Први закон термодинамике да бисмо пронашли исправну алтернативу:
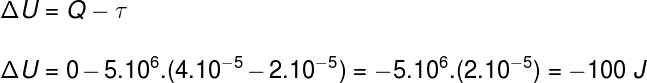
Питање 3)(вау) Кухињски канистер садржи гас високог притиска. Када отворимо овај цилиндар, примећујемо да гас брзо излази у атмосферу. Како је овај процес врло брз, можемо га сматрати адијабатским.
С обзиром на то да је први закон термодинамике дат са ΔУ = К - В, где је ΔУ промена енергије унутар гаса, К је енергија пренета у облику топлоте, а В је рад гаса, ово је тачно држава која:
а) Притисак гаса се повећао, а температура смањила.
б) Рад гаса је био позитиван и температура гаса се није мењала.
в) Рад гаса је био позитиван и температура гаса се смањила.
д) Притисак гаса се повећао, а изведени рад био негативан.
Резолуција
Алтернатива ц.
Једном када се запремина гаса прошири, кажемо да је обављени посао био позитиван, односно да је сам гас изводио радове на спољном окружењу. Даље, с обзиром да се процес одвија врло брзо, нема времена да гас размењује топлоту са околином, па се дешава следеће:
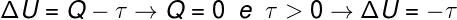
Према прорачуну, унутрашња енергија гаса се смањује за износ једнак обављеном послу. гасом, поред тога, с обзиром да долази до смањења унутрашње енергије гаса, долази и до смањења температура.
Питање 4)(Удесц) У лабораторији за физику спроводе се експерименти са гасом који се, у сврху термодинамичке анализе, може сматрати идеалним гасом. Из анализе једног од експеримената, у коме је гас подвргнут термодинамичком процесу, закључено је да је сва топлота која се допрема у гас претворена у рад.
Означите алтернативу која представља тачно термодинамички процес изведен у експерименту.
а) изоволуметријски процес
б) изотермни процес
в) изобарни процес
г) адијабатски процес
д) композитни поступак: изобарски и изоволуметријски
Резолуција
Алтернатива б.
Да би се сва топлота доведена у гас претворила у рад, не сме бити апсорпције унутрашње енергије другим речима, гас треба да прође кроз изотермни процес, односно процес који се одвија на температури константан.
Написао Рафаел Хеллерброцк
Наставник физике