О. натријум хлорид (кухињска со) је сол коју користимо у свакодневном животу за сољење ручно израђене или прерађене (индустријализоване) хране. То је супстанца која је такође присутна у разним природним намирницама које свакодневно конзумирамо, попут воћа, поврћа, махунарки, семена итд.
У овом тексту ћете знати све о овој важној супстанци за свакодневни живот човека:
дефиниција
Натријум хлорид припада неорганској функцији соли и састоји се од асоцијације натријумовог катиона (На+) то је анион цтамоорето (Кл-) кроз а јонска веза.
б) Хемијске карактеристике
Натријум хлорид се формира из два хемијска елемента:
→ Натријум (На):
припада породици метала (способних да лако формирају катионе) алкалних (АИ);
има електрон у валентној љусци;
има атомски број једнак 11;
има високу електропозитивност (способност губљења електрона).
→ Хлор (Цл)
припада породици халогена (ВИИА);
то је неметал (зато тако лако постаје анион);
има седам електрона у валентној љусци;
има атомски број једнак 17;
има високу електронегативност (способност добијања електрона).
Како су присутна два хемијска елемента која формирају натријум-хлорид, високу и високу електропозитивност електронегативности, између њих постоји јонска веза (успостављена између атома са тенденцијом губитка и добитка електрони).
Хемијска структура натријум хлорида састоји се од једног хлоридног аниона (зелена кугла), који делује у интеракцији са шест натријумових катиона (плаве сфере), као што се може видети у доњој структури:
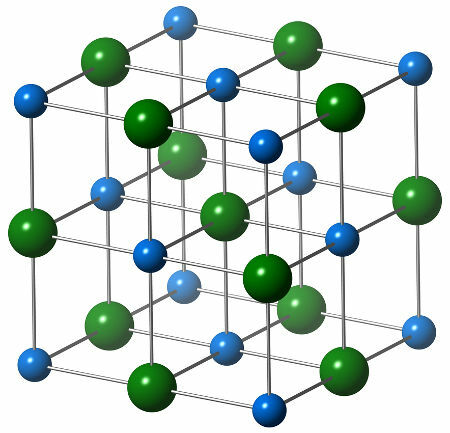
Приказ кристалне структуре натријум хлорида
в) Физичке карактеристике
Тачка фузије:
Натријум-хлорид се може претворити из чврстог у течно стање на температури од 801 О.Ц.
Тачка кључања:
Натријум-хлорид се може претворити из течног у гасовито стање на температури од 1465 О.Ц.
Поларитет
Како је реч о супстанци која је настала јонском везом, то јест зато што је јонско једињење, натријум хлорид је поларни.
Растворљивост у води
Можемо растворити у 1 Л воде, на 25 О.Ц, до 359 грама натријум хлорида.
Растворљивост у другим растварачима:
Како је натријум хлорид поларно једињење, не може се растворити у било ком растварачу неполарне природе, као што је уље.
Густина:
Густина натријум хлорида је 2,165 г / мл, стога је гушћа од воде која има густину једнаку 1 г / мл.
Електрична проводљивост:
Како је јонско једињење, натријум хлорид је способан да проводи електричну струју само када:
У растопљеном је стању, односно течност;
Растворен у води.
г) Методе добијања
Натријум хлорид се може добити физички или хемијски:
1О.) Добивање физичког:
фракциона кристализација
Натријум-хлорид се добија испаравањем воде из океана.
подземни рудници
Вади се у рудницима рударским техникама.
подземне наслаге
Извлачи се из дубоких подземних наслага растварањем у води (сол присутна у лежишту се раствара) и накнадним пумпањем.
2О.) Добијање хемијским путем
реакција синтезе
Натријум-хлорид се може добити хемијском реакцијом синтезе (из једноставних супстанци настаје једињење) између гасовитог хлора и металног натријума:
2 ин(с) + Кл2 (г) → 2 НаЦл(с)
Реакција неутрализације:
Други начин за хемијско добијање натријум-хлорида је реакција неутрализације између хлороводоничне киселине и натријум-хидроксида, у којој настаје сол и вода:
ХЦл(1) + НаОХ(овде) → НаЦл(овде) + Х2О.(1)
е) Значај за људе
Натријум-хлорид сам по себи нема функцију у људском телу, али када се дисоцира на натријумове катионе (На+) и хлоридни аниони (Цл-), сваки од ова два јона има неколико важних функција за наше тело. Погледајте неке од ових функција:
→ Функције натријумовог катјона (На+)
Спречава згрушавање крви;
Бори се против стварања бубрежних и жучних каменаца;
Учествује у регулацији телесних течности;
Учествује у регулацији крвног притиска.
→ Функције хлоридног аниона (Цл-)
Учешће у стварању и конституцији желучаног сока (хлороводонична киселина - ХЦл);
Учешће у стварању сока панкреаса.
ф) Оштећење људског тела
Прекомерна конзумација натријум хлорида може нанети следећу штету људима:
→ Штета настала услед вишка натријумових катјона у телу:
Повећано време зарастања рана;
Повећана учесталост грчеви;
Повећан крвни притисак;
Преоптерећење бубрега;
Повећано задржавање течности у телу.
→ Штета изазвана вишком хлоридних ањона у телу:
уништавање витамин Е.;
Смањење производње јода у телу.
г) Остале примене
Поред тога што се користи за сољење хране, натријум хлорид се такође може користити у следећим ситуацијама:
Производња шампона;
Производња папира;
Производња Натријум хидроксид (НаОХ);
Производња детерџената;
Производња сапуна;
Снег се топи на местима која пате од мећава;
Производња металног натријума;
Производња гаса хлора;
У изотоникима за замену електролита у телу;
У назалним деконгестивним растворима;
Производња физиолошког раствора; између осталих апликација.
Ја сам, Диого Лопес Диас