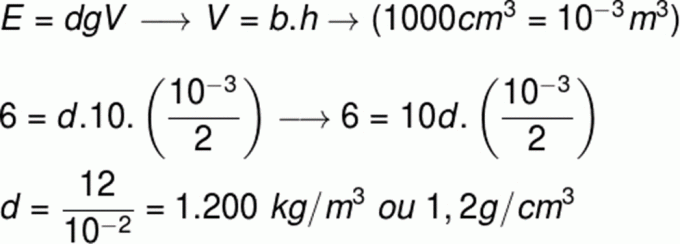У изоволуметријским процесима, запремина остаје константна и стога се не обавља никакав рад. Размењена топлота са медијумом једнака је промени унутрашње енергије система (види графикон горе).
Према Првом закону термодинамике, у било ком термодинамичком процесу количина топлоте К примљен од система једнак је раду који је обавио плус варијацији његове унутрашње енергије. Према томе, једначина која представља први закон следи у наставку:
К = τ + ∆У
Као што је речено у првом пасусу, где се каже да нема посла, морамо τ=0. Дакле, топлота која се размењује са медијумом једнака је повећању унутрашње енергије система. Тако имамо:
Не заустављај се сада... После оглашавања има још;)
К = ∆У
Када се у систем доведе топлота, односно када К је позитиван, унутрашња енергија ће се повећати; и када систем губи топлоту, односно када К је негативан, унутрашња енергија ће се смањивати. Процеси са константном запремином јављају се када је посуда која садржи материјал крута (нпр. Цилиндар са гасом).
Када прима топлоту, систем има тенденцију да се шири, али га ометају зидови посуда, па се притисак и температура система повећавају.
Аутор Домитиано Маркуес
Дипломирао физику
Да ли бисте желели да се на овај текст упутите у школи или у академском раду? Погледајте:
СИЛВА, Домициано Цорреа Маркуес да. „Први закон за изоволуметријске процесе“; Бразил Сцхоол. Може се наћи у: https://brasilescola.uol.com.br/fisica/primeira-lei-para-processos-isovolumetricos.htm. Приступљено 27. јуна 2021.