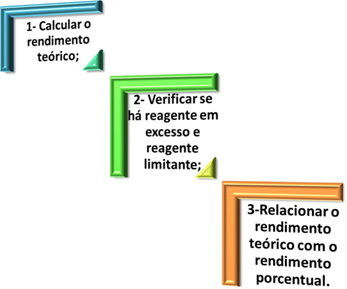
O uravnoteženje enačbe redukcije oksidacije temelji na enakosti števila oddanih elektronov in števila prejetih elektronov. Preprost način izvajanja tega uravnoteženja podajajo naslednji koraki:
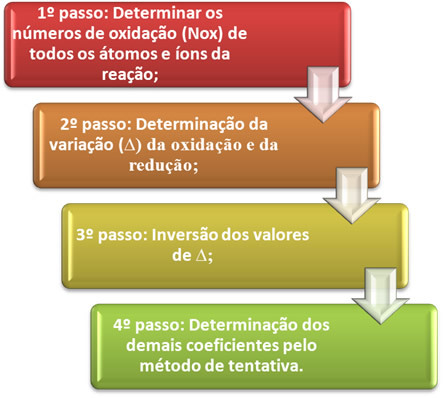
Poglejmo v praksi, kako uporabiti te korake, skozi naslednji primer:
Reakcija med vodno raztopino kalijevega permanganata in klorovodikovo kislino:
kmnO4 + HCl → KCl + MnCl2 + Kl2 + H2O
*1. korak:Določite oksidacijska števila:
Ta korak je pomemben, ker si običajno ne moremo hitro predstavljati, katere vrste so podvržene oksidaciji in redukciji.
+1 +7 -2 +1 -1 +1 -1 +2 -1 0 +1 -2
kmnO4 + HCl → KCl + MnCl2 + Kl2 + H2O
*2. korak:Določanje variacije oksidacije in redukcije:

Upoštevajte, da se mangan (Mn) zmanjša in klor (Cl) oksidira.
MnCl2 = OxNox = 5
Kl2 = OxNox = 2
Pri kloru lahko opazimo, da je HCl dal 3 spojine (KCl, MnCl2in Cl2), toda tisto, kar nas zanima, je Cl2, ker je vaš Nox doživel spremembe. Vsak klor, ki tvori Cl2 izgubi 1 elektron; saj za tvorbo vsakega Cl potrebujemo 2 klora2, potem se izgubita dva elektrona.
3. korak:Inverzija vrednosti ∆:
V tem koraku se vrednosti ∆ izmenjajo med omenjenimi vrstami in postanejo njihovi koeficienti:
MnCl2 = OxNox = 5 → 5 bo koeficient Cl2
Kl2 = OxNox = 2→ 2 bo koeficient MnCl2
kmnO4 + HCl → KCl + 2 MnCl2 + 5 Kl2 + H2O
Na tej točki je že mogoče poznati dva koeficienta enačbe.
Opazovanje: običajno se v večini reakcij ta obrat vrednosti opravi na 1. članu. Toda praviloma je treba to storiti pri članu, ki ima največje število atomov, ki so podvrženi redoksu. Če tega merila ni mogoče izpolniti, pretvorimo vrednosti za člana z največjim številom kemičnih vrst. To je bilo storjeno tukaj, saj ima drugi član več snovi.
Ne ustavi se zdaj... Po oglaševanju je še več;)
4. korak: Poskusno uravnoteženje:
kmnO4 + HCl → KCl + 2 MnCl2 + 5 Kl2 + H2O
- Ker sta v drugem članu dva atoma mangana, kot kaže koeficient, morata biti tudi v prvem. Torej imamo:
2 kmnO4 + HCl → KCl + 2 MnCl2 + 5 kl2 + H2O
- Tako je bila količina kalija (K) v 1. članu 2, kar bo enak koeficient za ta atom v drugem članu:
2 kmnO4 + HCl → 2 KCl + 2 MnCl2 + 5 Kl2 + H2O
- Količina klora (Cl) v 2. članu je skupaj 16, zato bo koeficient HCl 1. člana:
2 kmnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Kl2 + H2O
- Število vodikov v 1. članu je 16, torej koeficient vode (H2O) 2. člana bo enako 8, saj je množenje indeksa vodika (2) z 8 enako 16:
2 kmnO4 + 16 HCl → 2 KCl + 2 MnCl2 + 5 Kl2 + 8 H2O
- Če želimo preveriti, ali je enačba pravilno uravnotežena, lahko vidimo dva merila:
1.) Preverite, ali je količina vsakega atoma v obeh članih enaka:
2 kmnO4 + 16 HCl →2 KCl + 2 MnCl2 + 5 kl2 + 8 H2O
K = 2K = 2
Mn = 2 Mn = 2
Cl = 16 Cl = 16
H = 16 H = 16
O = 8 O = 8
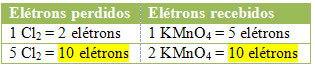
2.) Poglejte, ali je skupno število izgubljenih elektronov enako skupnemu številu prejetih elektronov:
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
FOGAÇA, Jennifer Rocha Vargas. "Uravnoteženje Roxi-redukcije"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/balanceamento-por-oxirreducao.htm. Dostopno 28. junija 2021.