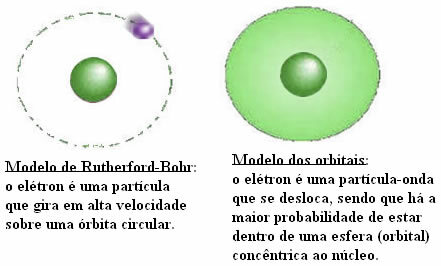
THE Teorija oktetov navaja, da mora biti atom kemičnega elementa stabilen, mora pridobiti elektronsko konfiguracijo žlahtnega plina, to pomeni, da mora imeti osem elektronov v valentni lupini ali dva elektrona, če ima atom samo prvo elektronsko lupino. (K).
Berilij ima atomsko število, enako 4. Torej ima vaš atom 4 elektrone in njegova elektronska porazdelitev v osnovnem stanju je podana z:

Berilijeva elektronska konfiguracija
To pomeni, da ima berilij v zadnji lupini 2 elektrona iz družine 2A (zemeljskoalkalijske kovine). Tako bi imel tendenco darovati ta dva elektrona, pri čemer bi dobil naboj 2+, to pomeni, da bi imel nagnjenost k tvorbi ionskih vezi.
Vendar je opaziti, da atomi berilija tvorijo kovalentne vezi z delitvijo elektronov, kot je prikazano v spodnji spojini, berilijev hidrid (BeH2):
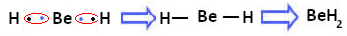
Nastanek kovalentnih vezi berilija z vodikom
Upoštevajte, da je v tem primeru berilij stabilen z manj kot osmimi elektroni v valentni lupini, ker je deli svoje elektrone kot atomi vodika, zdaj ima v zadnjem štiri elektrone plast. Zato je a izjema od pravila okteta.
Toda kovalentna vezava se običajno pojavi, ker ima element nepopolne orbitale. Na primer, kot je prikazano spodaj, ima vodik nepopolno orbitalo, zato tvori le eno kovalentno vez. Kisik ima dve nepopolni orbitali in tvori dve kovalentni vezi. Dušik ima nato tri nepopolne orbitale in posledično tvori tri kovalentne vezi:
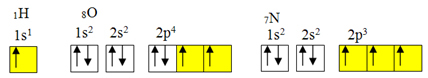
Elektronske porazdelitve vodika, kisika in dušika
Kot pa je že bilo prikazano, berilij nima nepopolnih orbital.
Ne ustavi se zdaj... Po oglaševanju je še več;)
Zakaj torej tvori kovalentne vezi?
Razlaga je v teorija hibridizacije, kar pravi, da ko elektron z orbite sprejme energijo, "skoči" na skrajno prazno orbitalo, bivanje v vzbujenem stanju in tako pride do fuzije ali mešanja nepopolnih atomskih orbital, ustvarjajo hibridne orbitale ki so si enakovredni in drugačni od prvotnih čistih orbital.
Na primer, v primeru berilija, elektron iz podnivoja 2s prejme energijo in preide na prazno orbitalo podnivoja 2p:

Vzbujeno stanje berilija za tvorbo hibridnih orbital
Na ta način ima berilij dve nepopolni orbitali, ki lahko tvorita dve kovalentni vezi.
Upoštevajte, da je ena orbita v podnivu "s", druga pa v "p", zato bi morale biti vezi, ki bi jih imel berilij, drugačne. Vendar se to ne zgodi, ker s pojavom hibridizacija, te nepopolne orbitale, ki so nastale, se bodo mešale in ustvarile dve imenovani orbitali hibridi ali hibridiziran, ki so med seboj enaki. Poleg tega, ker sta ti dve hibridni orbitali izhajali iz orbite "s" in "p", pravimo, da je ta hibridizacija tipa sp:

Nastanek hibridizacije Beryllium sp
Ker so hibridne orbitale enake, bodo kovalentne vezi, ki jih berilij tvori z vodikovimi atomi, enake:

Interpenetracije hibridnih berilijevih orbital z orbitalami vodikov
Upoštevajte, da nato naredi dve sigma vezi, ki sta tipa s-sp (σs-sp).
Avtorica Jennifer Fogaça
Diplomiral iz kemije