Ena reakcija energijske oksidacije v alkenih se pojavi, ko pride do pretrganja molekule, to je hkratnega prekinitve obeh dvojnih vezi in dovod kisika v organski molekuli.
To vrsto reakcije z alkeni je mogoče izvesti pri uporabi kalijevega permanganata (KMnO4) ali kalijev dikromat (K2Cr2O7) koncentrirano v kislem mediju, medtem ko je vroče.
V kislem mediju so H-ioni3O+ zaradi česar se KMnO razgradi4 in sproščanje 5 atomov nastajajočega kisika [O] na vsakih 2 KMnO4. Spodaj upoštevajte to razgradnjo:

Ta reakcija se imenuje "energična", ker pretrga dve vezi dvojnika (pri blagi oksidaciji se poruši le vez pi), še en dejavnik je, da je to zmanjšanje mangana v kislem mediju veliko bolj intenzivno kot v bazičnem mediju, kot je to storjeno v blago oksidacijo.
Nastajajoči sproščeni kisik nato reagira z alkenom, vendar je končni izdelek odvisen od tega vrste ogljika, ki povezujejo dvojno vez, torej če so primarne, sekundarne ali terciarno. Oglejte si, kaj se zgodi v vsakem primeru:
Ne ustavi se zdaj... Po oglaševanju je še več;)
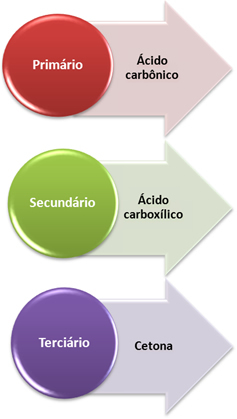
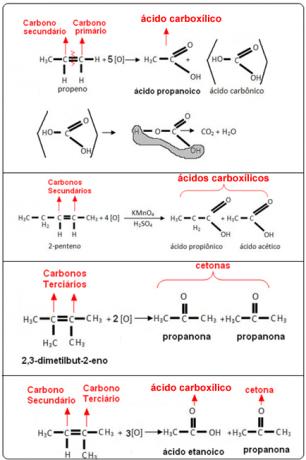
- Primarni ogljik: Če je nenasičenost med dvema primarnima ogljikoma, bosta nastala produkta dva ogljikove kisline (H2CO3). Če je samo eden izmed ogljikov v dvojni vezi primarni, bo le ena izmed nastalih molekul ogljikova kislina. Vendar pa je ta spojina nestabilna in nikoli ni bila izolirana, zato se razgradi voda in ogljikov dioksid.
- Sekundarni ogljik: Če je nenasičenost med dvema sekundarnima ogljikoma, bosta nastala dva produkta karboksilne kisline. Če je le eden izmed ogljikov sekundarni, bo nastala molekula karboksilne kisline, medtem ko bo drugi odvisen od drugega ogljika.
- Terciarni ogljik: Daje vzrok za keton.
Oglejte si spodnje primere:
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
FOGAÇA, Jennifer Rocha Vargas. "Energijska oksidacija alkenov"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/oxidacao-energetica-alcenos.htm. Dostopno 28. junija 2021.