THE solni most je predlagal angleški kemik Frederic Daniell leta 1836, ko je ta učenjak ustanovil baterijo poimenovan po njem (Danilov kup). ta most je cev v obliki črke U, ki ima dva porozna konca. (sestavljen iz bombaža ali agar-agarja) in vsebuje vodno raztopino, ki jo tvorita voda in sol. Posredno povezuje raztopini dveh polovičnih celic celice (anode in katode).
Opazovanje: Anoda je negativni pol akumulatorja in tam pride do oksidacije, katoda pa pozitivni pol in tam, kjer pride do redukcije.
Da bi razumeli pomen solnega mostu, je sprva treba razumeti delovanje kupa. Glejte spodnji diagram:
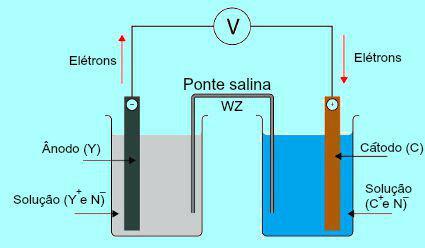
Splošna shema sklada Daniell
Na začetku je kovina (Y) plošče, ki je prisotna v anodi, podvržena oksidaciji. Pri oksidaciji se kovina spremeni v kation, ki pade v raztopino, v kateri je plošča. Zaradi tega začne anodna raztopina predstavljati višjo koncentracijo kationov (Y+). V tem primeru opazimo zmanjšanje anodne kovinske plošče.
Y → in- + Y+
Nato elektroni, izgubljeni med oksidacijo kovine anodne plošče, potujejo skozi zunanjo električno žico in gredo do kovinske plošče, ki je prisotna v katodi. Tako se plošča na katodi napolni z elektroni.
-
Sedanji kationi (C+) v raztopini premaknemo proti katodni plošči, ker je napolnjena z elektroni. Kationi ob pridobivanju elektronov, prisotnih v plošči, postanejo nevtralni (stabilni in trdni) in se nanjo oprimejo. Zaradi tega raztopina katode predstavlja večjo koncentracijo anionov kot kationov. V tem primeru opazimo povečanje velikosti katodne kovinske plošče.
Ne ustavi se zdaj... Po oglaševanju je še več;)
Ç+ + in- → C
Iz razumevanja, kako Danielov kup, je mogoče opaziti, da raztopina v anodi prejme večjo količino Y kationov+ zaradi oksidacije kovine X plošče. Raztopina, ki je v katodi, pa izgubi svoje katione (C+), ker trpijo zaradi zmanjšanja zobnih oblog.
Ravno pri tej temi je izpostavljeno delo solnega mostu. Glavna naloga tega mostu je spodbujati ravnovesje nabojev v raztopinah anode in katode. V solnem mostu imamo vedno sol (običajno kalijev klorid ali amonijev nitrat.), Ločeno v vodi. Oglejte si predstavitev enačbe v solnem mostu:
WZ + H2O → W+ + Z-
V solnem mostu sta dva iona (W+ in Z-), ki se premaknejo na katodo in anodo glede na:
The) Anoda sprejme anione (Z-), ki je prisoten v solnem mostu zaradi oksidacije elementa (Y), kar povzroči povečanje količine kationov (Y+) v raztopini.
B) Katoda sprejema katione (W+) solnega mostu, ker med delovanjem akumulatorja kation (C+), ki je prisoten v raztopini, se zmanjša na plošči. Tako ima raztopina katode večjo količino anionov (N-) in zato prejme kation, prisoten v solnem mostu.
Jaz, Diogo Lopes Dias
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
DNI, Diogo Lopes. "Jadranski most"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/ponte-salina.htm. Dostopno 28. junija 2021.



