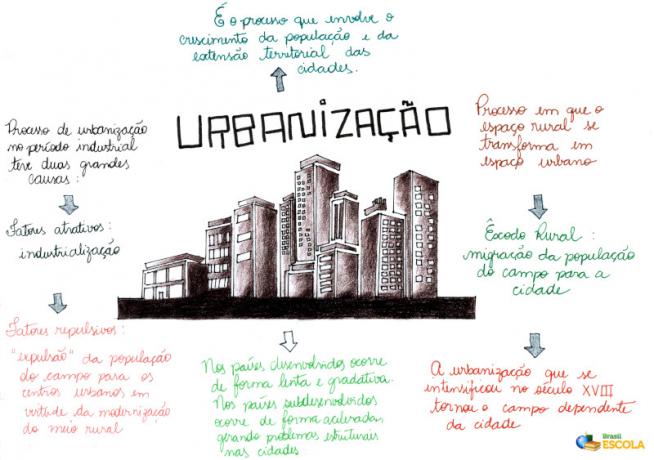
magmatska elektroliza je kemični pojav, pri katerem a ionska spojina katera koli (na primer sol ali baza) po postopku fuzije (prehod iz trdnega stanja v stanje tekočina), je izpostavljen zunanjemu električnemu toku, ki vodi do tvorbe dveh novih snovi kemična.
Ko je sol v postopku fuzije, je v tako imenovanem disocijacija ionski, v katerem sprosti kation in anion, kot je prikazano v spodnji enačbi:
XY(s) → X+(1) + Y-(1)
Po fuziji, ko gre električni tok skozi ta medij, se sproščeni ioni izpraznijo, kot je opisano spodaj.
anion podvrže se oksidaciji, izgubi elektrone in tvori preprosto snov, kot je predstavljena v spodnji enačbi:
Y.-(1) → Y2 + 2 in
V tem procesu se sprosti 2 mola elektronov, ker sta potrebna 2 mola aniona Y- da tvori molekulski Y (običajno z atomskostjo 2, Y2). Tako lahko svojo enačbo zapišemo na naslednji način:
2 Y-(1) → Y2 + 2 in
kation podvrže redukciji, pridobi elektrone in tvori preprosto (kovinsko) snov v skladu s spodnjo enačbo:
X+(1) + in → X(s)
Ker mora biti število elektronov v oksidaciji enako številu elektronov v redukciji, moramo zgornjo enačbo pomnožiti z 2, kar ima za posledico:
2 X+(1) + 2 in → 2 X(s)
Globalna enačba, ki predstavlja magmatska elektroliza je zgrajena iz vsote fuzijskih enačb, oksidacija in redukcija, pri čemer se izločijo vsi elementi, ki se ponovijo v reaktantu ene enačbe in v produktu druge.
Fuzija: 2 XY(s) → 2X+(1) + 2Y-(1)
Fuzijsko enačbo smo pomnožili z 2, da je bila enaka količini ionov glede na enačbe oksidacije in redukcije.
Fuzija: 2 XY(s) → 2X+(1) + 2Y-(1)
Oksidacija: 2 Y-(1) → Y2 + 2 in
Zmanjšanje: 2 X+(1) + 2 in → 2 X(s)
Global elektrolize: 2 XY(s) → Y2 + 2 X(s)
Glejte korak za korakom magmatska elektroliza z nekaj primeri:
1. primer: magmatska elektroliza natrijevega klorida (NaCl)
1. korak: Taljenje natrijevega klorida s segrevanjem soli.
NaCl(s) → V+(1) + Kl-(1)
2. stopnja: Oksidacija kloridnega kationa (Cl-).
Kl-(1) → Kl2 (g) + 2 in
Upoštevajte, da se sprosti 2 mola elektronov, ker sta za tvorbo molekularnega klora potrebna 2 mola kloridnega aniona2). V tem smislu lahko enačbo zapišemo:
2 Kl-(1) → Kl2 (g) + 2 in
3. stopnja: Zmanjšanje natrijevega kationa (Na+).
Ob+(1) + in → In(s)
Ne ustavi se zdaj... Po oglaševanju je še več;)
Ker mora biti število elektronov v oksidaciji enako številu elektronov v redukciji, moramo zgornjo enačbo pomnožiti z 2, kar ima za posledico:
2 v+(1) + 2 in → 2 In(s)
4. stopnja: Napiši fuzijsko enačbo.
Ker se je število kationov in anionov spremenilo, moramo enačbo, dobljeno v 1. koraku, pomnožiti z 2.
2 NaCl(s) → 2 In+(1) + 2 Kl-(1)
5. stopnja: Sestavljanje globalne enačbe magmatska elektroliza.
2 NaCl(s) → 2 In+(1) + 2 Kl-(1)
2 Kl-(1) → Kl2 (g) + 2 in
2 v+(1) + 2 in → 2 In(s)
Če želite sestaviti to globalno enačbo, preprosto odstranite element, ki se pojavi v reagentu enega koraka in produkt drugega koraka, kot v primeru Na+, Cl- in elektroni. Torej, globalna enačba bo:
2 NaCl(s) → Kl2 (g) + 2 v(s)
2. primer: Magmatska elektroliza aluminijevega bromida (AlBr3)
1. korak: Fuzija natrijevega klorida pri segrevanju soli.
AlBr3 (s) → Al+3(1) + 3Br-(1)
Kot v formuli soli obstajajo trije atomi broma (Br), zato se sprostijo 3 moli bromidnega aniona (Br)-).
2. stopnja: Oksidacija bromidnega kationa (Br-).
3Br-(1) → br2 (1) + 3 in
V tem postopku se sprosti 2 mola elektronov, ker sta za tvorbo molekularnega broma potrebna 2 mola bromidnega aniona2). Torej, da izenačimo število molov broma, moramo uporabiti koeficient 3/2 za spojino Br2:
3Br-(1) → 3/2 br2 (1) + 3 in
3. stopnja: Zmanjšanje aluminijevega kationa (Al+3).
Al+3(1) + 3 in → Al(s)
Ker mora biti število elektronov v oksidaciji enako številu elektronov v redukciji, moramo zgornjo enačbo pomnožiti z 2, kar ima za posledico:
2 Al+3(1) + 6 in → 2 Al(s)
4. stopnja: Popravek bromidne enačbe.
Tako kot v aluminijasti enačbi se uporablja šest elektronov, tako mora biti tudi v bromidni enačbi šest elektronov. Če želite to narediti, moramo enačbo pomnožiti z 2, kar ima za posledico:
6 br-(1) → 3 br2 (1) + 6 in
5. stopnja: Sestavljanje enačbe globalne magmatske elektrolize.
2 AlBr3 (s) → 2 Al+3(1) + 6 br-(1)
6 br-(1) → 3 br2 (1) + 6 in
2 Al+3(1) + 6 in → 2 Al(s)
Če želite sestaviti to globalno enačbo, preprosto odstranite element, ki se pojavi v reagentu enega koraka in produkt drugega koraka, kot v primeru Al+3, br- in elektroni. Torej, globalna enačba bo:
2 AlBr3 (s) → 3Br2 (1) + 2 Al(s)
Jaz, Diogo Lopes Dias
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
DNI, Diogo Lopes. "Kaj je magmatska elektroliza?"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-eletrolise-ignea.htm. Dostop 27. junija 2021.