O benzen je organska spojina, razvrščena kot aromatski ogljikovodik. Široko se uporablja kot surovina v industriji, v laboratorijskih procesih, v jeklarskih podjetjih in v petrokemični industriji za rafiniranje nafte.
Preberite tudi: Metan - najmanjši in najpreprostejši ogljikovodiki
Formula
Benzen je spojina z molekulsko formulo Ç6H6in kdo ima izjemno stabilna struktural. Strukturna formula za benzen je predstavljena na naslednji način:
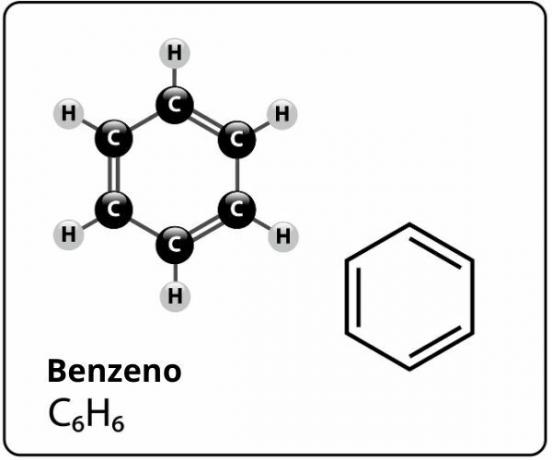
Kdo je predlagal to strukturo za benzen z šest atomov ogljika, vezanih skupaj z izmeničnimi dvojnimi vezmi, tvorijo šesterokotnik in imajo na vsakega od njih atom po vodik, je bil nemški kemik Friedrich August Kekule, leta 1866.
Benzen je izpostavljen pojavu resonanca, pri katerem se elektroni v vezah med ogljiki razlikujejo po svojem položaju. Iz tega razloga je benzen lahko predstavljen na naslednji način:
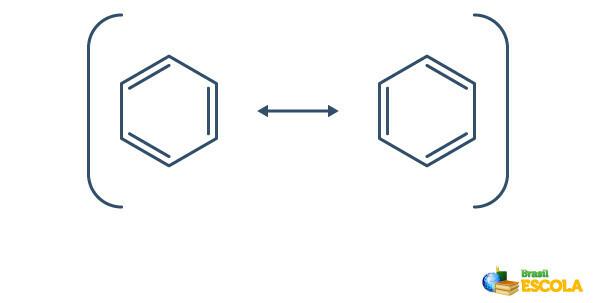
Dejanska struktura benzena je posrednik med zgoraj prikazanimi resonančnimi strukturami. To ne pomeni, da se benzen včasih pojavi v eni obliki, včasih drugi, niti da obe obliki obstajata hkrati. Benzen predstavljamo na naslednji način:
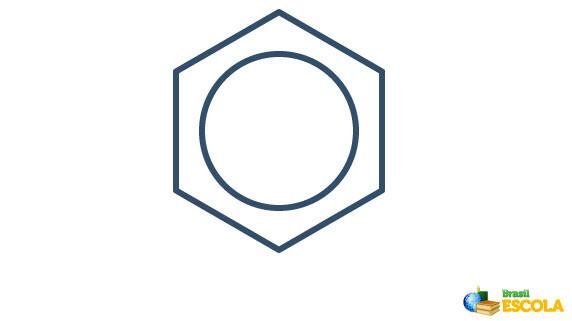
Krog znotraj šesterokotnika predstavlja resonanco med elektroni v vezi.
Ne ustavi se zdaj... Po oglaševanju je še več;)
Lastnosti
- Benzen je tekočina brezbarven, vnetljivo to je pogosto prijetna aroma značilnost.
- Molekulska formula: C6H6.
- Molska masa: 78,11 g / mol.
- Gostota: 0,876 g / cm³.
- Temperatura taljenja: 5,5 ° C.
- Temperatura vrelišča: 80,1 ºC - nizka temperatura vrelišča pojasnjuje njeno visoko hlapnost (lahkotnost izhlapevanja)
Benzen je a strupena snov in njegovi hlapi lahko povzročajo omotico, glavobol in omedlevico.
Preberite tudi:Ogljikov monoksid - izredno strupen plin brez barve in vonja
Uporaba in toksičnost benzena
benzen je uporablja se predvsem kot surovina v industriji za proizvodnjo drugih snovi, kot sta plastika in polimeri na osnovi stirena, smol, lepil, najlona, kavčukov, maziv, pesticidov itd.
Benzen je, predvsem v laboratorijih, nadomestil toluen, ki ima polarnost in topnost podoben benzenu, vendar je manj strupen in ima višjo temperaturo vrelišča.
Benzen spada v skupino kemične snovi, ki se štejejo za rakotvorne, ki povzročajo poškodbe kostnega mozga in levkemijo, če so dolgotrajno izpostavljeni v visokih koncentracijah. Kratkoročno lahko benzen povzroči omotico, zaspanost, pospešen srčni utrip, epileptične napade in omedlevico.
Ker je hlapljiva tekočina, benzen zlahka sprošča pline, zato onesnaženje benzena poteka predvsem skozi dihalne poti.
Kje najdemo benzen?
Večina benzena se sprosti v okolje rezultat človeškega delovanja, predvsem v industrijskih dejavnostih, lahko pa se sprosti tudi kot stranski produkt požarov in vulkanskih dejavnosti.
benzen je ena od sestavin snovi Nafta in je prisoten v bencinu, ki se sprošča v ozračje s sežiganjem avtomobilskih goriv. Poleg tega ga najdemo tudi v brezalkoholnih pijačah in cigaretah.

Polarnost
Benzen je a nepolarna molekula, tako kot vsi ostali Ogljikovodiki in zato predstavlja zelo majhna topnost v vodi (0,8 g / L pri 15 ° C). V nekaterih laboratorijskih postopkih se benzen uporablja kot organsko topilo za nepolarne snovi.
Nomenklatura
Obstaja pravilo, ki velja samo za nomenklaturo aromatičnih spojin, torej tistih, ki imajo v svoji strukturi benzen. To pravilo je razdeljeno na dva primera, ki sta odvisna od količine radikalov, pritrjenih na benzenski obroč.
1. ZADEVA: če je na benzenski obroč pritrjen samo en radikal, ime dobi po naslednjem pravilu:
RADIKALNO IME + BENZEN
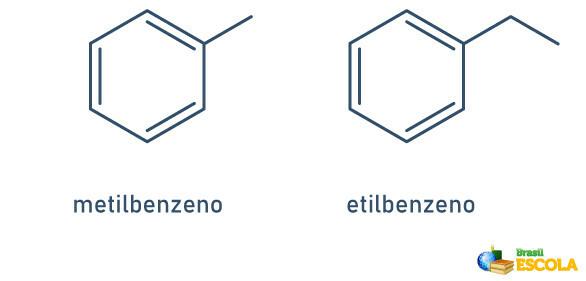
Upoštevajte, da ni treba navajati položaja stebla.
2. ZADEVA: kadar je na benzen vezano več radikalov, ime sledi naslednjemu pravilu:
RADIKALNI POLOŽAJ + RADIKALNO IME + BENZEN
Glej primer:

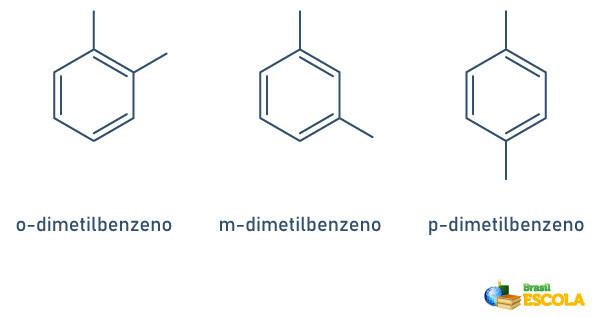
Kadar ima benzenski obroč le dva pritrjena radikala, lahko uporabimo posebno nomenklaturo:
- 1,2 ali orto (o);
- 1,3 ali cilj (m);
- 1.4 ali do (p).
Oglejte si primere:
Preberite tudi: Amonijev nitrat - visoko reaktivna spojina, ki se uporablja pri izdelavi eksplozivov
Zanimivosti
- Benzen je izredno rakotvorna snov, ki jo uvršča Mednarodna agencija raziskave raka, v skupini 1, skupaj s tobakom, dizelskim dimom in mesom obdelan.
- Obstaja več regulativnih organov, ki v različnih državah omejujejo izpostavljenost in emisije benzena. V Braziliji je za to vlogo odgovorna Anvisa.
- Preden smo vedeli, kakšna so njegova tveganja, so benzen zaradi prijetnega vonja uporabljali v kozmetiki, na primer po britju.
Avtor Victor Ricardo Ferreira
Učitelj kemije
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
FERREIRA, Victor Ricardo. "Benzen"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/benzeno.htm. Dostop 27. junija 2021.
Kemija

Aromatske spojine, areni, polarnost, netopni, topni, nepolarna topila, eter, ogljikov tetraklorid, ogljikovodiki, insekticidi, barvila, topila, eksplozivi, rakotvorne snovi, toluen, metilbenzen, zdravila, lepilo čevljar.