V laboratorijih in kemični industriji je zelo pomembno poznati količino snovi, ki sodelujejo v reakcijah. V nadaljevanju bomo obravnavali glavne koncepte, količine in merske enote, povezane z masami atomov:
- Enota za atomsko maso (u):
Standardni referenčni atom teže, ki označuje enoto atomske mase, je ogljik-12 (12Ç). Enota atomske mase (1 u) ustreza vrednosti 1,66054. 10-24 g, ki je masa 1/12 izotopa ogljika z maso, enako 12 (12Ç).
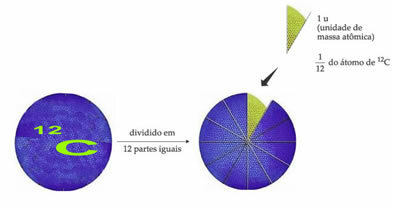
Enota atomske mase (u) je enota, uporabljena v vseh spodaj navedenih količinah.
- Atomska masa atoma ali izotopa (MA):
Dobimo ga s primerjavo z referenčno vrednostjo, omenjeno v prejšnji točki. Na primer atomska masa 919F dobi masni spektrometer, ki je enak 18,9984 u. Zaokroži navzgor, je enako 19, kar je enaka vrednosti kot njegovo masno število (A). Ta vrednost pomeni, da je atomska masa elementa 919F je 19-krat večja od mase 1/12 12Ç.
- Atomska masa elementa (AM):
Atomska masa elementa je določena s tehtanim povprečjem atomskih mas njegovih izotopov. To se naredi tako, da se atomske mase vsakega izotopa pomnožijo z odstotkom, ki se pojavi v konstituciji elementa. Nato se te vrednosti seštejejo, ki se delijo s 100, kar pomeni skupni odstotek.
Na primer, element neon je sestavljen iz treh izotopov z naslednjimi atomskimi masami in odstotki v svoji sestavi:

Izračun atomske mase (MA) tega elementa:
SLABneon = (20. 90,92) + (21. 0,26) + (22. 8,82)
100
SLABneon = 20.179 u
- Molekulska masa (MM):
Kot že ime pove, se uporablja za molekularne snovi, to je za atome, povezane z izmenjavo parov elektronov, ki se imenujejo kovalentne vezi.
Molekulsko maso dobimo tako, da število atomov vsakega elementa pomnožimo z atomskimi masami in seštejemo rezultate.
Na primer molekula CO2 vsebuje en ogljik in dva kisika, zato bomo atomsko maso ogljika pomnožili z 1; in kisik za dva, ki jih dodamo pozneje:
MMCO2 = (1. SLABÇ) + (2. SLABO)
MMCO2 = (1. 12) + (2. 16)
MMCO2 = 12 + 32
MMCO2 = 44 u
- Masna formula:
Za molekularno maso je enak izračun, vendar za ionske spojine. V tem primeru je ime drugačno, ker niso združeni v molekule, temveč v skupke ionov. Ker molekule ne obstajajo, o molekularni masi očitno nima smisla govoriti, vendar je utemeljitev za izračun enaka.
Primer:
NaCl
↓ ↓
23 +35,5 → Masa formule = 58,5 u
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Vir: Brazilska šola - https://brasilescola.uol.com.br/quimica/massas-dos-atomos.htm
