Oksidacija energije v alkini je organska reakcija, ki se pojavi, ko se alkinu (ogljikovodik, ki ima trojno vez med dvema ogljikoma) v kislo raztopino doda reagent z baeyer (Kalijev permanganat - KMnO4).
OPOMBA: reakcija oksidacija energije lahko izvedemo s kalijevim dikromatom (K2Cr2O7) in ne samo kalijevega permanganata.
Kadar koli reakcija od v alkinih poteka energijska oksidacija, proizvodi, iz katerih lahko izviramo, so karboksilne kisline, voda (edini element, ki se pojavi v katerem koli od njih) in ogljikov dioksid (CO2).
Baeyerjev reagent v kislem mediju
Ko Baeyerjev reagent zmešamo z vodo, v prisotnosti a kislina (snov, ki lahko sprošča ione H+), tvorba dveh oksidi (kalijev oksid in manganov oksid II) in nastajajoči kisiki ([O]).

Mehanizmi oksidacije energije v alkinih
1. mehanizem: prekinitev trojne vezi.
Na začetku trojno vez napadajo nastajajoči kisiki, ki jih tvori Baeyerjev reagent. Ta napad povzroči, da se trojna vez popolnoma pretrga.
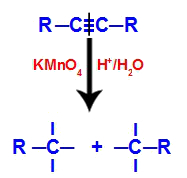
Motnje trojne vezi zaradi napada nastajajočih kisikov
Ko se trojna vez pretrga, se alkin razdeli na dva dela. Na vsakem ogljiku, ki se je trojno vezal, se pojavijo tri proste valence.
2. mehanizem: Medsebojno delovanje hidroksilnih skupin
Vsako od prostih valenc na ogljikih, kjer je bila trojna vez, zasedajo hidroksilne skupine (OH), ki tvorijo poliol (alkohol z več hidroksili).
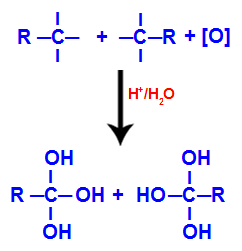
Tvorba poliola s hidroksilnimi skupinami po cepitvi trojne vezi
OPOMBA: Če ima ogljik, kjer je bila nekoč trojna vez, nanj pritrjen atom vodika, bo ta atom vodika dobil nastajajoči kisik in prav tako tvoril nov hidroksil.
3. mehanizem: Nastanek molekul vode
Ko ima ogljik dve ali več skupin OH, postane zaradi prisotnosti ekstremno zelo nestabilne strukture elektronegativ. Tako se molekula zaradi nestabilnosti samo-dehidrira, to pomeni, da se hidroksil veže na hidronij (H+) iz drugega hidroksila in tvori vodo.

Nastanek molekul vode iz dveh hidroksilov, ki sta prisotna v nastalem poliolu
4. mehanizem: Oblikovanje izdelka
Po tvorbi molekul vode ogljik izgubi vez zaradi izhoda iz hidroksil in kisik drugega hidroksila prav tako izgubi vez, ki je bila ustvarjena z a vodik. Zato se med tem ogljikom in kisikom pojavi dvojna vez, ki tvori karbonil (C = O) in stabilizira oba.
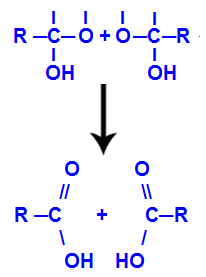
Tvorba karbonila v dveh strukturah, dobljenih iz alkina
Primer enačbe energijske oksidacije alkina
Primer: Energijska oksidacija But-1-ino
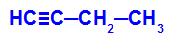
Strukturna formula but-1-yne
Ko but-1-yne damo v medij, ki vsebuje Bayerjev reagent, vodo in kislino, se vez pretrga. trojna med ogljiki 1 in 2 zaradi napada nastajajočih kisikov, ki obstajajo v sredini, kot v enačbi spodaj:
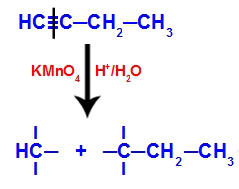
Prekinitev povezave but-1-yne
Po prekinitvi trojne vezi ogljika 1 in 2 prejmeta tri hidroksile, ogljik 1 pa enega več, ker imel je atom vodika (ki se veže na nastajajoči kisik) in je tvoril dva poliola (fragmenta 1 in 2).

Enačba, ki predstavlja tvorbo poliolov
Kmalu zatem, ker so polioli nestabilni, iz hidroksilov tvorimo molekule vode. V fragmentu 1 se pojavi molekula vode (ker obstajajo trije hidroksili), v fragmentu 2 pa dve molekuli (ker obstajajo štirje hidroksili).
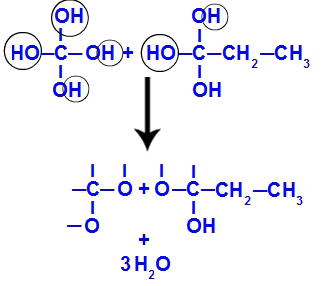
Nastanek molekul vode iz fragmentov but-1-yne
Končno imamo še dvojno vez med ogljiki, ki so izgubili hidroksil, in kisiki, ki so izgubili vodik, kar povzroča karbonile.

Tvorba karbonilov v fragmentih but-1-yne
Z zgornjo enačbo lahko vidimo, da je but-1-y povzročil karboksilno kislino in ogljikov dioksid (CO2).
Jaz, Diogo Lopes Dias
Vir: Brazilska šola - https://brasilescola.uol.com.br/quimica/oxidacao-energetica-alcinos.htm

