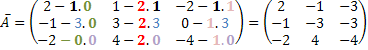Puferska raztopina je običajno mešanica šibke kisline in soli te kisline ali šibke baze in soli te baze. Ta raztopina je namenjena preprečevanju pojava zelo velikih sprememb pH ali pOH raztopine.
Spodaj je nekaj primerov vmesnih rešitev:

Učinkovitost puferske raztopine je vidna v naši krvi, kjer tudi z dodajanjem kisline ali baze v majhnih količinah v krvno plazmo pH skoraj ne pride do spremembe.
Kako se to zgodi, glede na to, da če v vodo dodamo kisline ali baze, se njen pH hitro spremeni?
Človeška kri je nekoliko osnovni puferski sistem, to je puferska tekočina: njen pH ostaja konstanten med 7,35 in 7,45. Enega najzanimivejših in najpomembnejših puferjev v krvi tvori ogljikova kislina (H2CO3) in s soljo te kisline natrijev bikarbonat (NaHCO3).

V tej puferski raztopini so naslednje vrste:
H2CO3: prisoten je v velikih količinah, saj je šibka kislina, ki jo malo ionizira;
H+: od ionizacije H2CO3;
HCO3-: prisoten tudi v velikih količinah zaradi ionizacije H2CO3 in disocijacija soli (NaHCO3);
Ob+: od ionizacije NaHCO3;
Če tej raztopini dodamo majhno koncentracijo kisline, pride do njene ionizacije, ki tvori H katione+, ki bo reagiral s HCO anioni3- prisoten v mediju s poreklom iz neionizirane ogljikove kisline. PH se ne spremeni.
Če dodamo bazo, se ustvarijo OH anioni-. Ti ioni se kombinirajo s kationi H+, iz ionizacije H2CO3. Tako so OH anioni- nevtralizirajo, ohranjajo pH medija.
Poleg omenjene puferske raztopine sta v krvi prisotni še dve: H2PRAH4/HPO42- in nekaj beljakovin. Če v krvi ne bi bilo takšnih puferskih raztopin, bi lahko bilo območje pH resno poševno. Če se pH krvi dvigne nad 7,8, se to imenuje alkaloza. Če pH pade preveč, pod 6,8, bo stanje acidoze. Oboje je nevarno, kar lahko privede do smrti.

Avtorica Jennifer Fogaça
Diplomiral iz kemije
Vir: Brazilska šola - https://brasilescola.uol.com.br/quimica/solucaotampao-no-sangue-humano.htm