Goriva, ki se uporabljajo v večini avtomobilov, sta bencin in etanol. Popolno zgorevanje teh dveh goriv ustvarja ogljikov dioksid (CO2 (g)) in vodo (H2O). Žal pa lahko nepopolno zgorevanje in nečistoče v alkoholu in bencinu ustvarijo snovi, ki zelo onesnažujejo okolje. V primeru bencina se ogljikov monoksid (CO(g)); ogljikovodiki (spojine iz ogljika in vodika), kot je etan (C2H6 (g)); in dušikovi oksidi (NOx), predvsem dušikov monoksid (NO) in dušikov dioksid (NO2 (g)).
Da bi se izognili povečanju onesnaženosti zraka, potrebujejo vsi avtomobili poklicano opremo katalizator ali katalitični pretvornik, ki je naprava proti onesnaževanju, ki ima funkcijo obdelave teh plinov, ki jih sprošča motor z notranjim zgorevanjem, in preoblikovanja v manj škodljive pline. V ta namen se v nekaterih industrijskih procesih uporabljajo tudi katalizatorji.
Omenjeni onesnaževalni plini zapustijo motor in vstopijo v katalizator, prehajajoč skozi nekakšen "panj", katere celice so praviloma izdelane iz keramike ali kovinskega materiala, ki je prevlečen z aluminijevim oksidom (aluminijev oksid - Al
2O3). Ta oblika satja z majhnimi kanali je pomembna, ker zagotavlja veliko kontaktno površino plinov, zaradi česar se hitreje odzovejo.Toda pravi katalizator je kovina, ki sedi na vrhu aluminijevega oksida. Običajno se uporabljajo kovine paladij, rodij, platina ali molibden. Te kovine lahko tudi mešate in uporabljate zlitine. Na primer pri bencinu se običajno uporablja zlitina paladija in torija; v primeru etanola se uporabi druga zlitina paladija in molibdena. Te kovine izvajajo heterogeno katalizo z onesnaževalnimi plini.
heterogena kataliza gre za vrsto reakcije, pri kateri katalizator tvori z reaktanti (v tem primeru onesnažujočimi plini) večfazni sistem. To je zato, ker katalizator adsorbira, to pomeni, da zadrži molekule reaktantov na svoji površini, oslabi njihove vezi in pospeši reakcijski proces.
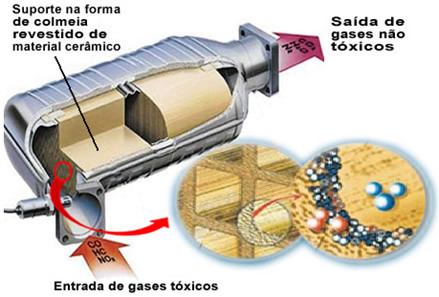
Posledično katalizatorske kovine preoblikujejo onesnaževala, kot sta CO in NOx v nestrupenih plinih, kot je CO2, H2O, o2 in ne2. Oglejte si nekatere od teh reakcij spodaj in opazite, da skozi njih pride do oksidacije ogljikovodikov in CO (pridobljen iz nepopolnega zgorevanja) in tudi redukcija dušikovih oksidov v dušikov plin (N2):
2 CO(g) + 2 NE(g) → 2 CO2 (g) + 1 N2 (g)
2 CO(g) + 1 O2 (g) → 2 CO2 (g)
2C2H6 (g) + 7 O.2 (g) → 4 CO2 (g) + 6 H2O(v)
2 ŠT2 (g) +4 CO(g) → 1 N2 (g) + 4 CO2 (g)
2 ŠT2 (g) → 1 N2 (g) + 2 O2 (g)
2 ŠT(g) → 1 N2 (g) + 1 O2 (g)
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Vir: Brazilska šola - https://brasilescola.uol.com.br/quimica/conversor-catalitico.htm
