Ko kuhamo hrano v svojih domovih, uporabljamo zgorevanje s kuhalskim plinom. Ena od stvari, ki jo lahko vidimo v plamenu, ki je posledica zgorevanja tega plina, je, da je njegova barva običajno zelo svetlo modra. Vendar je pri večini reakcij izgorevanja, na primer pri sežiganju sveče, plamen rumen.

Potem se postavlja vprašanje:
"Če je vsak požar rezultat reakcije zgorevanja, zakaj imajo nekateri plameni različne barve?"
Da bi razumeli, kako se to zgodi, moramo razumeti, kaj je reakcija izgorevanja in katere snovi so prisotne v vsaki od omenjenih reakcij.
Reakcija zgorevanja se pojavi, ko oksidant (plinasti material, ki vsebuje kisik) porabi gorivo (oksidativni material) za proizvodnjo toplotne energije (toplote).
Druga pomembna točka, ki jo moramo vedeti o reakcijah izgorevanja, je, da lahko potekajo v popolna ali nepopolna. Če je za porabo goriva dovolj kisika, bo reakcija popolna in nastaja ogljikov dioksid (CO2) in vodo (H2O). V nasprotnem primeru bo zgorevanje delno, nepopolno, pri čemer nastaja ogljikov monoksid (CO) in voda; ali ogljik (C) in voda.
V obeh primerih, ki jih analiziramo, je oksidant kisik, prisoten v zraku. Vendar pa so goriva drugačna. Kuharski plin je dejansko utekočinjeni naftni plin (UNP), ki je mešanica ogljikovodikov (alkanov), glavno gorivo pa je butan (C4H10). Tako kuhalni plin sestavljajo samo molekule alkana tri ali štiri atome ogljika, zato je za popolno zgorevanje potrebno malo kisika. To reakcijo lahko izrazimo na naslednji način:
1C4H10 (g) + 13/2 O.2 (g) → 4 CO2 (g) + 5 ur2O(g), ∆H <0
Pri svečah je parafin gorivo za reakcijo in je sestavljen iz mešanice alkanov z atomi ogljika, ki od 20 do 36. S tem za popolno reakcijo je potrebno veliko več kisika. Glej primer:
1C24H50 (s) + 70/2 O.2 (g) → 25 CO2 (g) + 25 H2O(g), ∆H <0
V zraku ni dovolj kisika za popolno zgorevanje, zato poteka nepopolno, kot je prikazano spodaj:
1C24H50 (s) +49/2 O.2 (g) → 24 CO(g) + 25 H2O(g), ∆H <0
1C24H50 (s) +25/2 O.2 (g) → 24C(s) + 25 H2O(g), ∆H <0
Nepopolne reakcije proizvedejo manj energije kot popolno zgorevanje. To pojasnjuje razliko med barvami plamenov, saj ima rumeni plamen, značilen za nepopolno zgorevanje, manjšo energijo. Modri plamen je značilen za popolno zgorevanje z večjo energijo.
To tudi pojasnjuje nastanek saj v plamenu sveče (na sliki spodaj), ki je ogljik, ki velja za produkt nepopolnega zgorevanja.
Toda zakaj je v gorilniku Bunsen možno dobiti rumen in modr plamen, ko se gorivo ne spremeni?
V primeru gorilnika Bunsen je to doseženo z regulacijo dovoda plina in zraka. Če je okno zaprto in povzroči vstop majhne količine zraka, bo dobljeni plamen rumen, ker bo imel dovolj kisika za popolno zgorevanje. Če je regulacija mešanice plina in zraka ustrezna, dobimo modri plamen.
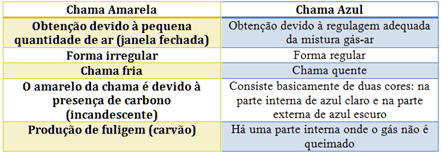
Oglejte si značilnosti vsake v spodnji tabeli:
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Vir: Brazilska šola - https://brasilescola.uol.com.br/quimica/combustao-chamas-cores-diferentes.htm
