Naučite se uporabiti prvi zakon termodinamike v različnih situacijah, rešite naloge in preverite svoje znanje z rešenimi in razloženimi nalogami.
Vprašanje 1
Prvi zakon termodinamike pravi, da:
a) Energije ni mogoče ustvariti ali uničiti, lahko pa jo pretvorimo iz ene oblike v drugo.
b) Energija se vedno ohranja, vendar je ni mogoče pretvoriti iz ene oblike v drugo.
c) Energijo lahko ustvarimo ali uničimo, ne moremo pa je pretvoriti iz ene oblike v drugo.
d) Energije ni mogoče ohraniti, lahko pa jo pretvorimo iz ene oblike v drugo.
Prvi zakon termodinamike je princip ohranjanja energije, torej v sistemu zaprta, ostane količina energije nespremenjena in se lahko samo preoblikuje iz ene oblike v drugo. drugo.
vprašanje 2
Predpostavimo zaprt sistem, ki prejme 100 J toplote, medtem ko opravi 50 J dela. Kolikšna je sprememba notranje energije sistema?
a) -50 J
b) 0 J
c) 50 J
d) 100J
e) 150 J
Preverjanje znakov:
Prejeta toplota je pozitivna Q > 0.
Opravljeno delo je pozitivno W > 0.
Po prvem zakonu imamo:
vprašanje 3
Idealen plinski sistem izmenja 500 joulov toplote z zunanjim okoljem. Ob predpostavki, da je ta proces izometrično ohlajanje, določite delo oziroma notranjo energijo.
a) 500 J in 0 J
b) - 500 in 0 J
c) 0 J in 500 J
d) 0 J in - 500 J
e) -500 J in 500 J
Ker je proces izometričen, se prostornina ne spremeni, zato je delo nič.
Po prvem zakonu termodinamike:
Ker gre za hlajenje, sistem izgublja toploto, zato:
vprašanje 4
8 molov idealnega plina v sistemu bat-cilinder stisnemo z delom 1000 J. Pri tem se v zunanje okolje izgubi 400 J toplote. Njegova notranja energija in sprememba njegove temperature sta enaki
Podano: R = 8,31 J/mol. K
a) - 1400 J in približno variacijo 6 K
b) 600 J in približno variacijo 6 K
c) 600 J in približno variacijo 14 K
d) - 1400 J in približno variacijo 14 K
notranja energija
Ker sistem prejme delo, je njegov predznak negativen, prav tako toplota, ki se pri tem izgubi.
Prvi zakon termodinamike je:
Če nadomestimo vrednosti, dobimo:
R = 8,31 J/mol K
Temperatura
Po Joulovem zakonu imamo:
vprašanje 5
Popoln plin je podvržen stiskanju in opravi delo 500 J. Na koncu te transformacije se je notranja energija sistema spremenila za 200 J manj kot na začetku. Količina toplote, ki jo je izmenjal plin, je bila
a) - 700 J
b) - 300 J
c) 300J
d) 0J
e) 700 J
Ker je bilo delo prejeto, to je odporno delo, je njegov predznak negativen.
Zamenjava vrednosti v enačbo prvega zakona termodinamike:
vprašanje 6
(CEDERJ 2021) V fazi cikla, ki ga izvaja idealni plin v klimatski napravi, se tlak plina poveča, tako da ostane njegova prostornina konstantna. Na tej stopnji cikla so delo W, ki ga opravi plin, količina toplote Q, ki jo absorbira, in sprememba njegove temperature ΔT naslednji:
a) W < 0, Q < 0 in ΔT < 0
b) W = 0, Q > 0 in ΔT > 0
c) W = 0, Q = 0 in ΔT = 0
d) W > 0, Q > 0 in ΔT > 0
podatki:
Tlak P se poveča;
Glasnost ostane konstantna;
delo
Ker je prostornina konstantna, je delo W enako nič.
Prvi zakon termodinamike gre takole:
Ker je toplota pozitivna, bo tudi sprememba notranje energije pozitivna.
Toplota
Ker se toplota absorbira, je pozitivna.
Temperatura
Po zakonu o plinu:
Kje,
n je število molov
R je univerzalna plinska konstanta
Temperatura je torej odvisna le od tlaka, saj je prostornina konstantna in pozitivna.
vprašanje 7
(UNICENTRO 2018) V skladu s prvim zakonom termodinamike je sprememba notranje energije sistema, ΔU, podana z razliko med toploto, izmenjano z zunanjim okoljem, Q, in delom, W, opravljenim v procesu termodinamični. Če se monoatomski plin razširi tako, da vedno ostane pri isti temperaturi, lahko ob upoštevanju te informacije to transformacijo predstavimo z enačbo
a) ΔU + W = 0
b) ΔU − W =0
c) Q − W = 0
d) Q + ΔU = 0
Izotermni proces poteka brez spremembe temperature.
Energija je povezana s temperaturo z:
Kjer je n število molov in R univerzalna plinska konstanta. Ker sta n in R konstantna, obstaja samo nihanje temperature in
Prvi zakon termodinamike gre takole:
vprašanje 8
(URCA 2016) V skladu s prvim zakonom termodinamike, če se med izotermnim procesom, ki ga izvaja idealni plin s fiksno maso, plin sprosti količina toplote, katere magnituda je 50 cal, potem sta sprememba notranje energije in delo, ki ga opravi plin v tem procesu, oziroma:
a) 0 in 50 kal.
b) 50 cal in 0.
c) 0 in 0.
d) 50 cal in -50 cal.
e) 0 in -50 kal.
Sprememba notranje energije je neposredno povezana s spremembo temperature. Ker je proces izotermičen, ni temperaturnih sprememb, torej .
Iz prvega zakona termodinamike:
Ker se toplota sprošča, je njen predznak negativen.
vprašanje 9
(UFRN 2012) Biomasa je eden glavnih virov obnovljive energije, zato so stroji, ki jo uporabljajo kot gorivo za proizvodnjo električne energije, pomembni z okoljskega vidika. Zelo pogost primer je uporaba biomase za pogon parne turbine za ustvarjanje dela. Slika ob strani shematično prikazuje poenostavljeno termoelektrarno.
V tej termoelektrarni izgorevanje biomase v peči proizvaja toploto, ki segreva vodo v kotlu in ustvarja visokotlačno paro. Para pa se po ceveh vodi do turbine, ki pod njenim delovanjem začne vrteti svoje lopatice.
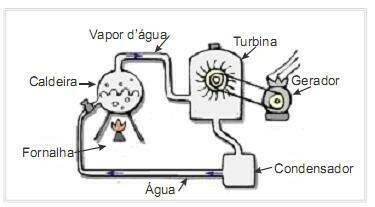
Predpostavimo, da so toplotne izgube zaradi temperaturnih razlik med deli tega toplotnega stroja in okoljem zanemarljive. V tem kontekstu je sprememba notranje energije kotlovske vode
a) je večja od vsote toplote, ki ji je dovedena z izgorevanjem biomase in opravljenim delom na turbini.
b) je enaka vsoti toplote, ki ji je dovedena z zgorevanjem biomase z delom, opravljenim na turbini.
c) je enaka razliki med toploto, ki jo dovajamo z zgorevanjem biomase, in delom, opravljenim na turbini.
d) je večja od razlike med toploto, ki jo dovajamo s sežiganjem biomase, in delom, opravljenim na turbini.
Voda v kotlu prejema energijo v obliki toplote pri izgorevanju goriva in sprošča energijo v obliki dela, opravljenega na turbini.
vprašanje 10
(UECE 2021) Glede lastnosti plinov bodite pozorni na naslednje izjave:
jaz. Pri idealnem plinu je notranja energija samo funkcija tlaka.
II. Toplota, ki jo absorbira plin, ko spremeni svoje stanje, je neodvisna od procesa.
III. Notranja energija idealnega plina je samo funkcija temperature in je neodvisna od procesa.
IV. Pri izotermnem raztezanju idealnega plina je delo, ki ga opravi, enako absorbirani toploti.
Pravilno je, kar je navedeno samo v
a) I in II.
b) III in IV.
c) I in IV.
d) II in III.
III. PRAVILNO. Notranja energija idealnega plina je samo funkcija temperature in je neodvisna od procesa.
Sprememba notranje energije je neposredno povezana s spremembo temperature.
Kjer je n število molov in R je idealna plinska konstanta, ker je konstanta, samo temperatura določa notranjo energijo plina.
IV. PRAVILNO. Pri izotermnem raztezanju idealnega plina je delo, ki ga opravi, enako absorbirani toploti.
Ker je izotermičen, ni spremembe temperature, zato je sprememba notranje energije enaka nič. Po prvem zakonu termodinamike:
Izvedite več z:
- Prvi zakon termodinamike
- Termodinamika: zakoni, koncepti, formule in vaje
- Vaje iz termodinamike
- zakon o plinu
ASTH, Rafael. Vaje iz prvega zakona termodinamike.Vse zadeve, [n.d.]. Na voljo v: https://www.todamateria.com.br/exercicios-da-primeira-lei-da-termodinamica/. Dostop na:
Glej tudi
- Vaje iz termodinamike
- Termodinamika
- adiabatna transformacija
- Vaje iz termokemije
- Prvi zakon termodinamike
- Naravoslovje in njihove tehnologije: Enem
- Termalna energija
- Drugi zakon termodinamike
