Kisli oksidi so tisti oksidi, ki pri reakciji z vodo tvorijo kislino kot produkt. Pri reakciji z bazo bodo proizvodi sol in voda.
Te spojine imajo običajno kovalentni značaj, to pomeni, da so molekularne, topne v vodi in jih tvorijo večinoma nekovine, ki so elementi z visoko elektronegativnostjo. Ko jih tvorijo kovine, imajo visoke oksidacijske številke (električni naboj).
Primeri:
CO2, SAMO2, SAMO3, P2O5, Cl2O6, PRI2, št2O4, št2O5itd.
Sledi splošna shema značilnih reakcij kislih oksidov in primer:
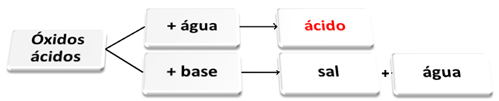
Kisli oksidi, ki reagirajo z vodo in bazo
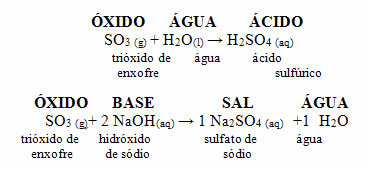
Prav tako se imenujejo kisli oksidi anhidridi, ker ta beseda prihaja iz grščine anhidros, kar pomeni "brez vode", kislinski oksidi pa se lahko štejejo za „brezvodno kislino“.
Lastnosti in uporaba nekaterih kislinskih oksidov:
• Ogljikov dioksid (ogljikov dioksid) - CO2:
Ta spojina se uporablja kot plin v brezalkoholnih pijačah in v mineralnih vodah, saj je pod visokim pritiskom topna v vodi. V teh izdelkih proizvaja kisli medij, saj je kisli oksid, ki reagira z vodo in proizvaja kislino v skladu s spodnjo reakcijo:

Pod 78 ° C je v trdnem stanju in je znan kot suhi led, ki je svoje ime dobil, ker je po videzu podoben ledu. pogost, vendar se ne stopi in prehaja v tekoče stanje pri sobni temperaturi, ampak gre v parno stanje, to je sublimuje. Tako se ta funkcija uporablja kot scenski vir pri koncertih, filmih, gledališčih, zabavah itd.

Ogljikov dioksid je kisli oksid
Najdemo ga tudi v ozračju zaradi človeškega dihanja, izgorevanja fosilnih goriv (premog, naftni derivati, alkohol itd.) In gozdnih požarov. Tako je eden tistih, ki so odgovorni za kisli dež.
• Žveplovi oksidi - SO2 in tako3
Ti oksidi so tudi v ozračju naravnega in umetnega izvora. Naravni nastane zaradi vulkanskih izbruhov in razgradnje rastlin in živali. Umetno ustreza največji količini teh oksidov v ozračju, kakršni so izženejo s sežiganjem fosilnih goriv, predvsem dizelskega olja, ki vsebuje žveplo, kot je nečistoče.
Žveplov dioksid (SO2) reagira s kisikom iz ozračja, pri čemer nastane žveplov trioksid (SO3). Ko ta zadnji oksid reagira z deževnico, nastane žveplova kislina, ki je zelo močna in povzroča škodo.
• Sežiganje žvepla iz goriv: S + O2 → OS2
• Preoblikovanje SO2 v SO3: SO2 + ½2 → OS3
Reakcije SO2 in SO3 z vodo, ki daje kisline: SO2 + H2O → H2SAMO3
SAMO3 + H2O → H2SAMO4
• dušikovi tetroksidi (dušikov-dušikov anhidrid) - N2O4
Ta spojina ima vrelišče 22 ° C, ima rumeno barvo in je precej hlapna. V ozračju nastane z oksidacijo dušika in je lahko v tekoči obliki v obliki dimera mononitrovega dioksida ali dušikovega oksida (NO2). Nad to temperaturo ima obliko NO2:
N2O4 ↔ NE2
Je izredno strupen plin in njegovo vdihavanje je usodno. Uporablja se tudi v sestavi raketnih goriv.
Avtorica Jennifer Fogaça
Diplomiral iz kemije
