THE oksidacijo in zmanjšanje so reakcije, ki se pojavijo, ko je prenos elektronov med kemičnimi vrstami. Gre za nasprotni reakciji: pri oksidaciji pride do izgube elektronov, pri redukciji pa do pridobivanja elektronov.
Ti procesi potekajo sočasno, ker ko snov odda elektrone drugi, se ta oksidira, medtem ko se snov, ki prejme elektrone, reducira.
Ko snov oksidira, povzroči redukcijo drugih vrst, od tod tudi ime redukcijsko sredstvo. Podobno ena snov reducira zaradi oksidacije druge in je zato oksidant.
Reakcije oksidacije in redukcije so prikazane z variacijo oksidacijskega števila (nox) vključenih vrst.
Na splošno lahko reakcijo, ki predstavlja oksidacijo in redukcijo, predstavimo z:
A + B+ → A+ + B
Kje,
A: snov, ki oksidira, izgubi elektrone, poveča svojo vrednost in je redukcijsko sredstvo.
B: snov, ki se reducira, pridobiva elektrone, zmanjšuje oksidacijo in je oksidacijsko sredstvo.
Primeri oksidacije in redukcije
Glej naslednjo sliko za primer redoks kemijske enačbe.
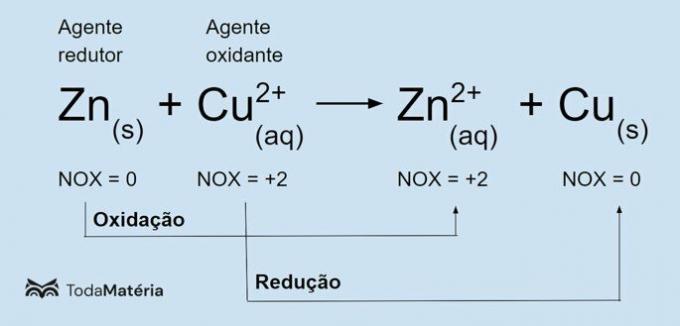
Kovinski cink se podvrže
oksidacijo in povzroča redukcijo bakra, zato je redukcijsko sredstvo. Njegovo oksidacijsko število (nox) se poveča od 0 do +2, ker izgubi 2 elektrona.Bakrov ion (Cu2+) se reducira in povzroči oksidacijo bakra, zato je oksidacijsko sredstvo. Njegovo oksidacijsko število (nox) se zmanjša z +2 na 0, ker pridobi 2 elektrona in postane kovinski baker, ki je električno nevtralen.
Drugi primeri redoks reakcij v vsakdanjem življenju so:
zgorevanje metana
CH4(g) + 2O2(g) → CO2(g) + 2H2O(v)
fotosinteza
6CO2(g) + 6H2O(v) → C6H12O6 (tukaj) + 6O2(g)
korozija železa
2Fe(s) + 3/4O2(g) + 3 ure2O(v) → 2Fe (OH)3 (s) (rje Fe2O3.3H2O)
Izvedite več o oksidacijsko število (nox).
Kako potekajo reakcije oksidacije in redukcije?
Enačbo redoks reakcije, ki vključuje baker in cink, lahko predstavimo s polovičnimi reakcijami, kot je prikazano spodaj.
- polovična reakcija oksidacije: Zn0(s) → 2e- + Zn2+(tukaj)
- Redukcijska polovična reakcija: rit2+(tukaj) + 2e- → rit0(s)
- globalna enačba: Zn0(s) + rit2+(tukaj) → Zn2+(tukaj) + rit0(s)
Ta prenos elektronov v redoks reakciji poteka v skladu z redukcijskim potencialom vključenih vrst. Komponenta z najnižjim redukcijskim potencialom ima tendenco oddajanja elektronov, medtem ko jih bo tista z najvišjim potencialom prejela.
Na primer, cink ima redukcijski potencial -0,76 V, medtem ko ima baker redukcijski potencial +0,34 V. Zato je cink, ker ima manjši redukcijski potencial, boljše redukcijsko sredstvo in spodbuja redukcijo baker, ki ima večji redukcijski potencial in zato pridobiva elektrone in povzroča oksidacijo cinka.
Preberite tudi o redoks reakcije.
Vaje o oksidaciji in redukciji
Z naslednjimi vprašanji preverite svoje znanje o tem, kar ste se naučili v tem besedilu.
Vprašanje 1
Kar zadeva reakcije oksidacije in redukcije, je pravilno trditi, da
a) Povečanje nox kemične vrste kaže, da se je zmanjšala.
b) Snov, ki izgublja elektrone, oksidira in je oksidant.
c) Pri redoks reakcijah pride do prenosa elektronov.
d) Snov, ki pridobiva elektrone, se reducira in je reducent.
e) Zmanjšanje nox kemične vrste kaže, da je bila podvržena oksidaciji.
Pravilna alternativa: c) Pri oksidacijsko-redukcijskih reakcijah pride do prenosa elektronov.
Pri redoks reakcijah se elektroni prenašajo.
Snov, ki pridobi elektrone, se reducira in je oksidant. Zmanjšanje nox kemične vrste kaže, da se je zmanjšal.
Snov, ki izgubi elektrone, se oksidira in je redukcijsko sredstvo. Povečanje nox kemične vrste kaže, da je bila podvržena oksidaciji.
vprašanje 2
Primeri redoks reakcij v vsakdanjem življenju RAZEN
a) Korozija
b) zgorevanje
c) Fotosinteza
d) Nevtralizacija
Nepravilna alternativa: d) Nevtralizacija.
Reakcija nevtralizacije je tista, ki se pojavi med kislino in bazo, kar ima za posledico sol in vodo. Na primer:
NaOH + HCl → NaCl + H2O
Primeri redoks reakcije so:
zgorevanje metana
CH4(g) + 2O2(g) → CO2(g) + 2H2O(v)
fotosinteza
6CO2(g) + 6H2O(v) → C6H12O6 (tukaj) + 6O2(g)
korozija železa
2Fe(s) + 3/4O2(g) + 3 ure2O(v) → 2Fe (OH)3 (s)
vprašanje 3
Opazuj naslednje oksidacijsko-redukcijske reakcije in navedi, katera sta oksidant in reducent.
JAZ. Zn0(s) + rit2+(tukaj) → Zn2+(tukaj) + rit0(s)
II. rit2+(tukaj) + H2(g) → 2H+(tukaj) + rit(s)
III. Zn(s) + 2H+(tukaj) → Zn2+(tukaj) + H2(g)
Odgovor:
Pri redoks reakciji je tisti, ki je podvržen oksidaciji, redukcijsko sredstvo, tisti, ki je podvržen redukciji, pa je oksidant.
JAZ. Zn0(s) + rit2+(tukaj) → Zn2+(tukaj) + rit0(s)
Oksidant: baker (Cu)
Reducent: cink (Zn)
II. rit2+(tukaj) + H2(g) → 2H+(tukaj) + rit(s)
Oksidant: baker (Cu)
Reducent: vodik (H)
III. Zn(s) + 2H+(tukaj) → Zn2+(tukaj) + H2(g)
Oksidant: vodik (H)
Reducent: cink (Zn)
Pridobite več znanja z vsebinami:
- Kaj so skladi?
- elektrokemija
- elektroliza
Bibliografske reference
FONSECA, M. R. M kemija, 2. 1. izd. São Paulo: Attica, 2013.
SANTOS, W.L.P; MOL, G.S. Državljanska kemija, 3. 2. izd. São Paulo: Editora AJS, 2013.
USBERCO, J. Poveži kemijo, 2: kemija. - 2. izd. São Paulo: Saraiva, 2014.