Elektronska porazdelitev se nanaša na to, kako so elektroni razporejeni v plasteh ali energijskih ravneh, ki obdajajo jedro atoma.
Po atomskem modelu Rutherford-Böhr ima atomov znanih kemičnih elementov največ sedem elektronske plasti, ki povečujejo energijo od znotraj proti zunanjosti jedra (1 – 2 – 3 – 4 – 5 – 6 – 7). Teh sedem plasti lahko označimo tudi z ustreznimi črkami K – L – M – N – O – P – Q, pri čemer je K prvi, ki je bližje jedru in ima najnižjo energijo. Po drugi strani je plast Q sedma, ki je najbolj oddaljena od jedra in tista z največjo energijo.
Ker ima vsak atom atomsko število (količino protonov v jedru) in različno število elektronov, elektronske plasti vsakega atoma imajo različne energije, ki držijo elektrone s to energijo odločen.
Mind Map: Elektronska distribucija

* Če želite prenesti miselni zemljevid v PDF-ju, Klikni tukaj!
Spodaj si oglejte nekaj atomov in elektronov, razporejenih v njihovih elektronskih plasteh:

Atom vodika, helija, berilija in kisika
Upoštevajte, da je porazdelitev štirih atomov berilija: 2 – 2, kisika pa 2 – 6. Samo iz teh primerov je mogoče videti, da elektronska distribucija sledi vrstnemu redu. Na primer, lupina K (1) ima lahko največ dva elektrona.
Spodaj imamo tabelo, ki določa največjo količino elektronov, ki se lahko porazdelijo v vsaki elektronski plasti:
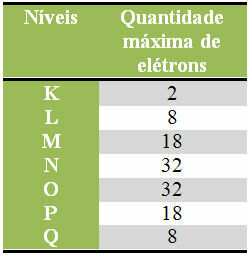
Največje število elektronov v elektronskih nivojih
Prav tako je treba spomniti, da mora imeti zadnja lupina, ki jo je treba napolniti, tako imenovana valenčna lupina, največ osem elektronov. Torej, če ste razdelili elektrone in videli, da je imela zadnja lupina količino večjo od 8, vendar manjšo da mora 18 torej pustiti le 8 elektronov v tej lupini in dodati preostale v naslednjo lupino plus zunanji.
Ne nehaj zdaj... Po reklami je še več ;)
Upoštevajte na primer elektronsko porazdelitev atoma kalcija. Če pogledamo periodni sistem, vidimo, da ima atomsko število enako 20, medtem ko je v osnovnem stanju enako število elektronov. Torej moramo porazdeliti 20 elektronov v njihove elektronske lupine. Oglejte si ga spodaj:
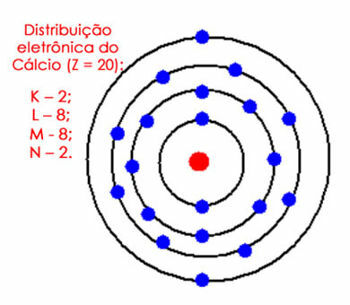
Elektronska porazdelitev kalcija v atomu
Upoštevajte, da lahko lupina M zadrži do 18 elektronov, če pa vanjo damo preostale elektrone, bi imela 10 elektronov, kar se v valenčni lupini ne more zgoditi. Tako damo druge elektrone (2) v naslednjo lupino, ki je N.
Če pa je količina elektronov v zadnji lupini med 18 in 32, pustite 18 elektronov, preostale pa prenesete na zunanje lupine. Glej še en primer:
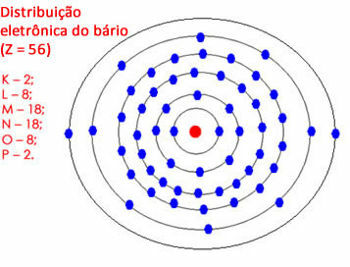
Elektronska porazdelitev barija v atomu
Upoštevajte, da lahko lupina "N" vsebuje največ 32 elektronov, tukaj pa bi jih imela 28. Tako pustimo 18 elektronov, preostale pa prepustimo naslednji lupini. Toda lupina "O" bi imela 10 elektronov, zato smo pustili 8 in preostala 2 elektrona razdelili v lupino "P".
Vendar pa obstaja lažji način za izvedbo te elektronske porazdelitve atomskih elektronov. To je skozi Paulingov diagram (odkar ga je ustvaril znanstvenik Linus Carl Pauling (1901-1994)), znan tudi kot elektronski distribucijski diagram ali pa še, Diagram energijskih nivojev. Ta diagram izgleda takole:
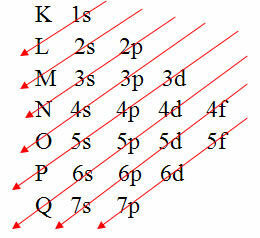
Grafična predstavitev elektronske distribucije je podana s Paulingovim diagramom
Če želite razumeti, kako so elektronske porazdelitve elektronov in ionov narejene v tem diagramu, preberite spodnja besedila:
* porazdelitev elektronov;
* elektronska distribucija ionov.
* Slika avtorja Linusa Paulinga: Nobelprize.org
** Mind Map avtorja Diogo Lopes
Avtor: Jennifer Fogaça
Diplomirala iz kemije
Ali se želite sklicevati na to besedilo v šolskem ali akademskem delu? Poglej:
FOGAÇA, Jennifer Rocha Vargas. "Kaj je elektronska distribucija?"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-distribuicao-eletronica.htm. Dostop 27. julija 2021.
Kemija

Niels Bohr, Bohrov atom, atomska fizika, stabilni atom, atomski model, planetarni sistem, plasti elektrosfere, energijske ravni, elektronske lupine, energija elektronov, atomski model Rutherford, atom vzbujenega stanja.
