Kp je kratica, ki se uporablja za določanje konstanta ravnotežja glede na delne pritiske. Ta konstanta deluje na primer z vrednostmi plinastih udeležencev ravnotežja v enoti atm.

Enačba, ki predstavlja kemijsko reakcijo s plinastimi komponentami
V tej enačbi so vsi udeleženci plinasti, torej ko ima sodelujoči plin a delni tlak v mešanici, predstavlja ga okrajšava pX.
Pri postavitvi enačbe kemijskega ravnotežja (glede na koncentracijo) je treba produkte postaviti v števec, reaktante pa v imenovalec:
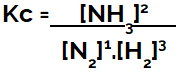
Kc izražanje ravnotežja tvorbe amoniaka
izraz ravnotežna konstanta glede na tlak (Kp) sledi vzorcu Kc, to pomeni, da so delni tlaki reagentov postavljeni v imenovalec, delni tlaki produktov pa v števcu:
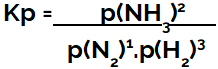
Kp izražanje ravnotežja tvorbe amoniaka
Opazovanje: Če je reakcijska enačba kemično ravnovesje ne predstavi nobenega plinastega udeleženca, se ne bo samodejno predstavil Kp.
Primer: (PUC-MG) Za reakcijo: 2 CO(g) + O2 (g)? 2 CO2 (g), parcialni tlaki CO(g) to je2 (g) v ravnotežju sta 0,2 atm oziroma 0,4 atm. Skupni tlak v sistemu je 1,4 atm. Vrednost Kp kajti reakcija je:
a) 56.2
b) 40,0
c) 35.6
d) 28.4
e) 25.6
Podatki, pridobljeni z vadbo, so:
parcialni tlak ogljikovega monoksida (pCO) = 0,2 atm;
Parcialni tlak ogljikovega monoksida (pO2) = 0,4 atm;
Skupni tlak =1,4 atm;
Za določitev Kp tega sistema moramo izvesti naslednje korake:
1. korak: Določite parcialni tlak ogljikovega monoksida (pCO2).
Za to ne pozabite, da je skupni tlak (pt) vsota vseh delnih tlakov:
pt = pCO + pCO2 + pO2
1,4 = 0,2 + p (CO2) + 0,4
1,4 - 0,2 - 0,4 = pCO2
pCO2 = 0,8 atm
2. korak: Določite Kp vaje.
Za to samo uporabite vrednosti v izrazu ravnotežne konstante Kp:
Kp = (pCO2)2
(pCO)2.(prah2)1
Kp = (0,8)2
(0,2)2.(0,4)1
Kp = 0,64
0,04.0,4
Kp = 0,64
0,016
Kp = 40 atm-1
Jaz, Diogo Lopes Dias
vir: brazilska šola - https://brasilescola.uol.com.br/o-que-e/quimica/o-que-e-kp.htm


