Organska kemija je široko področje kemije, ki preučuje ogljikove spojine.
Znanja iz organske kemije se lotevamo na več načinov, in ob premisleku smo za vas sestavili predlagane vaje, sprejemne izpite in vprašanja Enem.
Uporabite tudi komentarje resolucij, če želite izvedeti še več o temi.
Predlagane vaje
Vprašanje 1
Oglejte si spodnje organske spojine in ugotovite organske funkcije glede na poudarjene funkcionalne skupine. Po tem poimenujte snovi.
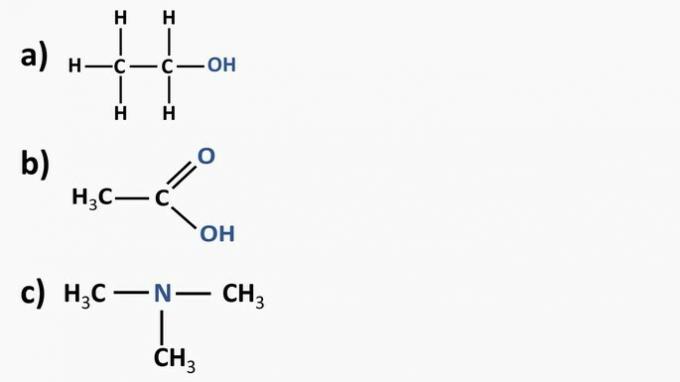
Odgovor:
a) organska spojina: etanol
- organska funkcija: alkohol
- Splošna formula: R — OH
- Identifikacija: hidroksil (OH), povezan z ogljikovo verigo
b) organska spojina: etanska kislina.
- Organska funkcija: karboksilna kislina
- Splošna formula: R — COOH
- Identifikacija: karboksilni radikal (COOH), povezan z ogljikovo verigo
c) organska spojina: trimetilamin
- Organska funkcija: amin (terciarni)
- Splošna formula:
- Identifikacija: dušik, povezan s tremi ogljikovimi verigami
2. vprašanje
V organski kemiji spojine prepoznamo po verigah, ki jih tvorita ogljik in vodik. Vendar pa so lahko drugi elementi del kemijske strukture teh spojin, na primer kisik.
Izberite alternativo, kjer imata obe organski spojini kisikove organske funkcije.
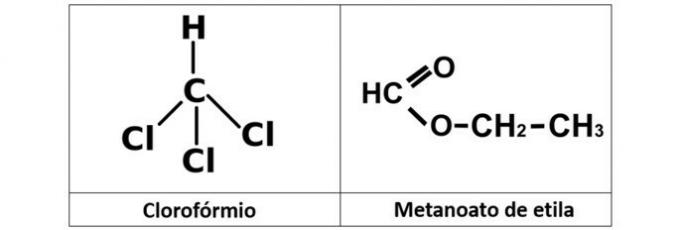
a) kloroform in etil metaneat
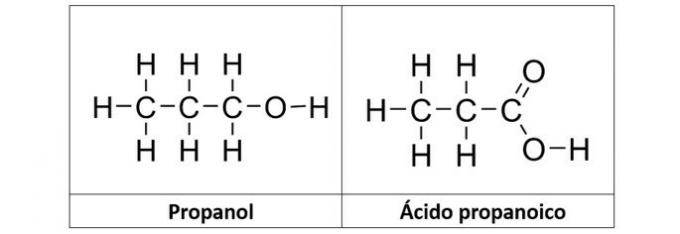
b) propanol in propanojska kislina
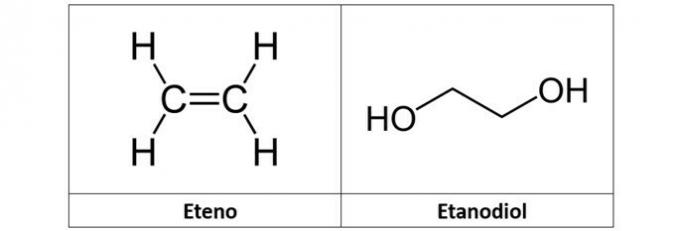
c) eten in etandiol
d) etanamid in benzen
Pravilen odgovor: b) propanol in propanojska kislina
a) NAPAK. Imamo kloroform (CHCl3), ki je alkil halogenid, in etil metanoat ester (C3H6O2), ki v svoji strukturi vsebuje kisik.
b) PRAVILNO. V tej alternativi imamo dve spojini, ki imata kisikove organske funkcije. Propanol (C3H8O) je alkohol, ki ga tvorijo trije ogljiki. Propanojska kislina (C3H6O2) je karboksilna kislina.
c) NAPAK. Etilen (C2H4), imenovan tudi etilen, je ogljikovodik alkenskega tipa. Že etandiol (C2H6O2) je alkohol z dvema hidroksiloma v svoji strukturi.
d) NAPAČNO. Etanamid (C2H5NO) je amid, benzen pa aromatski ogljikovodik in ga tvorijo le ogljik in vodik.

3. vprašanje
Oglejte si strukturo organske spojine spodaj in preverite resnične trditve.

(01) Spojina ima organsko dušikovo funkcijo.
(02) Je primarni amin, saj je povezan samo z enim vodikom.
(03) Ime spojine je dietilamin.
Pravi odgovor:
(01) PRAVILNO. Funkcija organskega dušika v spojini je amin.
(02) NAPAKA. Je sekundarni amin, saj je dušik povezan z dvema ogljikovima verigama.
(03) NAPAK. Ime spojine je dimetilamin, saj sta na dušik pritrjena dva metilna radikala.
4. vprašanje
Eugenol, član družine fenilpropanoidov, je aromatična organska spojina, ki je prisotna v nageljnovih žbicah, začimbi, ki se uporablja že v starih časih.

Upoštevajte strukturno formulo spojine in ugotovite prisotne organske funkcije.
a) Alkohol in eter
b) Fenol in eter
c) Alkohol in ester
d) Fenol in ester
e) Alkohol in ogljikovodik
Pravilna alternativa: b) Fenol in eter.
Eugenol ima v verigi kisikove organske funkcije, to pomeni, da je poleg atomov ogljika in vodika prisoten tudi heteroatom kisik.
Za organsko funkcijo fenola je značilen hidroksil (-OH), pritrjen na aromatski obroč. V funkciji etra se kisik nahaja med dvema ogljikovima verigama.
5. vprašanje
EDTA, katere polno ime je etilendiamintetraocetna kislina, je organska spojina s številnimi aplikacijami. Zaradi svoje sposobnosti vezave kovinskih ionov je kelatno sredstvo, ki se pogosto uporablja tako v laboratoriju kot tudi v industriji.
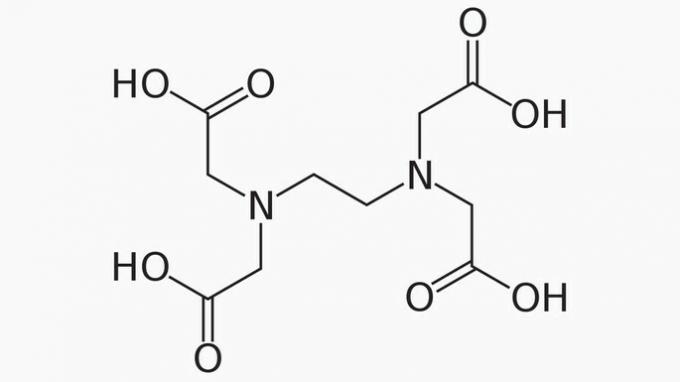
Glede EDTA je pravilno trditi, da je ogljikova veriga:
a) Odprto, homogeno in nenasičeno.
b) Zaprto, heterogeno in nasičeno.
c) Odprto, heterogeno in nenasičeno.
d) Zaprto, homogeno in nasičeno.
e) Odprto, heterogeno in nasičeno.
Pravilen odgovor: e) Odprt, heterogen in nasičen.
Veriga EDTA je razvrščena na:
ODPRTO. Glede na razporeditev ogljikovih atomov v strukturi EDTA lahko vidimo, da se zaradi prisotnosti koncev veriga spojine odpre.
HETEROGENA. Ogljikova veriga ima poleg ogljikovih in vodikovih spojin heteroatome dušika in kisika.
ZASITEN. Vezi med ogljikovimi atomi so nasičene, saj ima veriga samo enojne vezi.
Več o tem na: Organska kemija.
vprašanja sprejemnega izpita
Vprašanje 1
(UFSC) Opazujte nepopolne organske strukture in določite pravilne elemente:
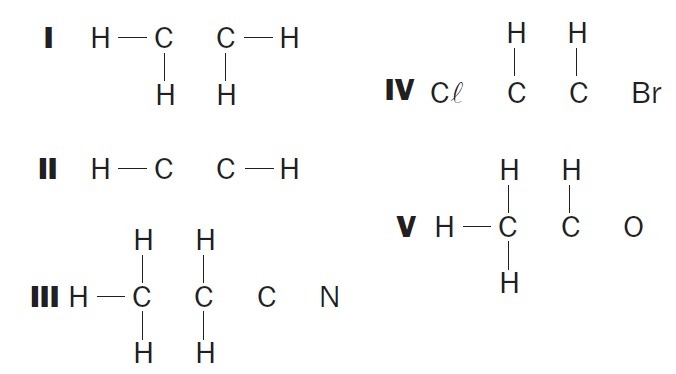
(01) Struktura I nima ene same vezi med atomi ogljika.
(02) Struktura II nima trojne vezi med atomi ogljika.
(03) Struktura III nima dveh enojnih vezi med atomi ogljika in trojne med atomi ogljika in dušika.
(04) Struktura IV nima dveh enojnih vezi med ogljikovimi atomi in halogeni ter dvojne vezi med ogljikovimi atomi.
(05) V strukturi V ni enotne vezi med atomi ogljika in enojne vezi med atomi ogljika in kisika.
Pravilne alternative: 02, 03 in 04.
Poleg ogljika, obveznega kemičnega elementa v organskih spojinah, so lahko v strukturah prisotni tudi drugi elementi, ki so vezani s kovalentnimi vezmi, kjer se delijo elektroni.
Valenca elementov določa število vezi, ki se lahko tvorijo, kot je prikazano v spodnji tabeli.
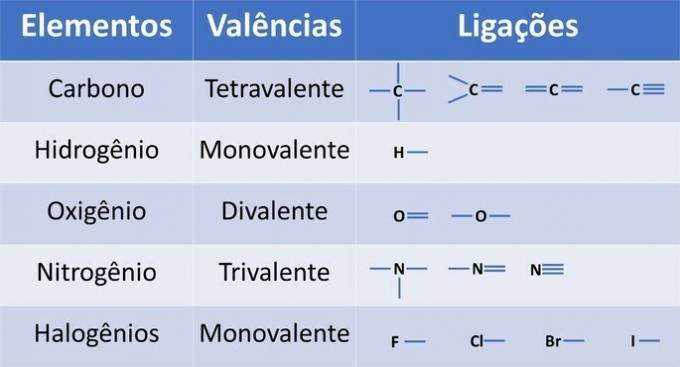
Iz teh informacij imamo:
(01) NAPAKA. Struktura nima dvojne vezi med atomi ogljika, da bi tvorila etenovo spojino.
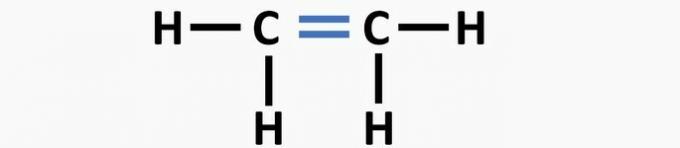
(02) PRAVILNO. Struktura nima trojne vezi med atomi ogljika, da bi tvorila etinsko spojino.
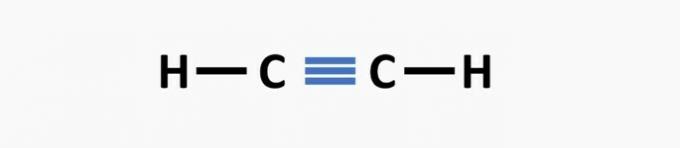
(03) PRAVILNO. V strukturi manjkajo enojne vezi med ogljiki in trojne vezi med ogljikom in dušikom, da nastane spojina propanenitril.
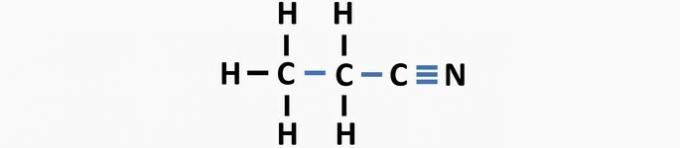
(04) PRAVILNO. V strukturi ni enojnih vezi med ogljikom in halogenom in dvojnih vezi med ogljiki, da bi tvorili dikloroetensko spojino.
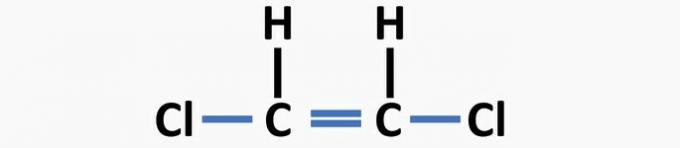
(05) NAPAK. V strukturi manjka enojna vez med ogljiki in dvojna vez med ogljikom in kisikom, da tvori etansko spojino.
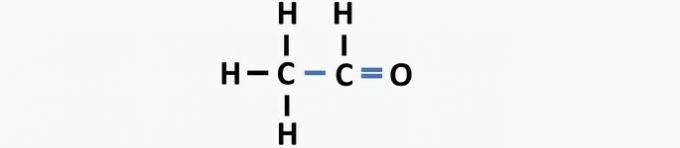
2. vprašanje
(UFPB) Struktura organske spojine z molekulsko formulo C5H8Kar predstavlja razvejano, nenasičeno, heterogeno in aliciklično verigo, je:

Pravilna alternativa: d.
Ogljikove verige lahko razvrstimo na naslednji način:
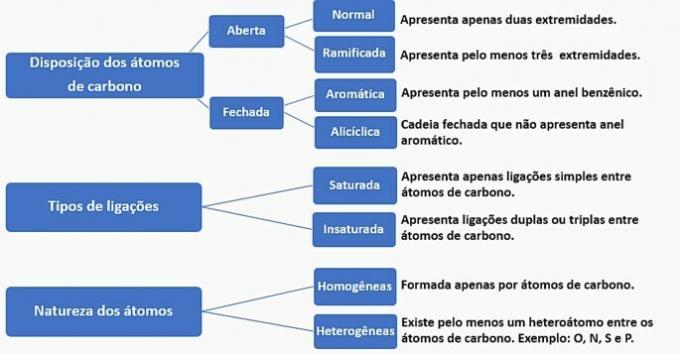
Glede na te podatke imamo:
a) NAPAK. Veriga je razvrščena kot običajna, nasičena, homogena in aliciklična.
b) NAPAK. Veriga je razvrščena kot običajna, nenasičena, homogena in odprta.
c) NAPAK. Veriga je razvrščena kot razvejana, nenasičena, homogena in odprta.
d) PRAVILNO. Veriga je razvrščena kot razvejana, nenasičena, heterogena in aliciklična
- Ima vejo: metilni radikal;
- Ima nenasičenost: dvojna vez med ogljiki;
- Ima heteroatom: kisik je vezan na dva ogljika;
- Predstavlja zaprto verigo: ogljiki, povezani v krog, brez aromatičnega obroča.
e) NAPAK. Veriga je razvrščena kot razvejana, nenasičena, heterogena in odprta.
3. vprašanje
(Centec-BA) V spodnji strukturi so oštevilčeni ogljiki:
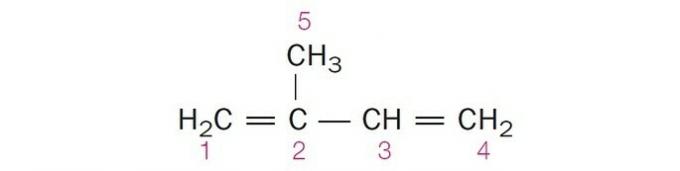
a) sp2, sp, sp2, sp2, sp3.
b) sp, sp3, sp2, sp, sp4.
c) sp2, sp2, sp2, sp2, sp3.
d) sp2, sp, sp, sp2, sp3.
e) sp3, sp, sp2, sp3, sp4.
Pravilna alternativa: c) sp2, sp2, sp2, sp2, sp3.
Ker ima v valentni lupini 4 elektrone, je ogljik četverovalenten, to je, da ima tendenco, da tvori 4 kovalentne vezi. Te obveznice so lahko enojne, dvojne ali trojne.
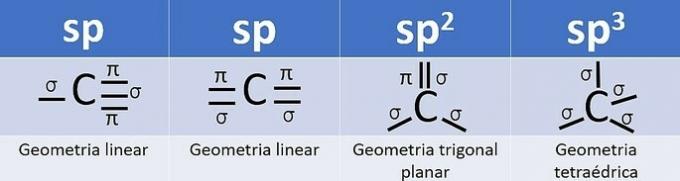
Število hibridnih orbital je vsota sigma-vezi (σ) ogljika, saj vez ne hibridizira.
- sp: 2 sigma povezavi
- sp2: 3 sigma povezave
- sp3: 4 sigma povezave
Glede na te podatke imamo:
a) NAPAK. Ogljik 2 ima sp hibridizacijo2, saj ima 3 σ vezi in eno vez .
b) NAPAK. Ogljik nima sp hibridizacije4 in sp hibridizacija nastopi, kadar med ogljiki obstaja trojna ali dve dvojni vezi.
c) PRAVILNO. Vsota σ vezi na vsakem ogljiku daje alternativno hibridizacijo.
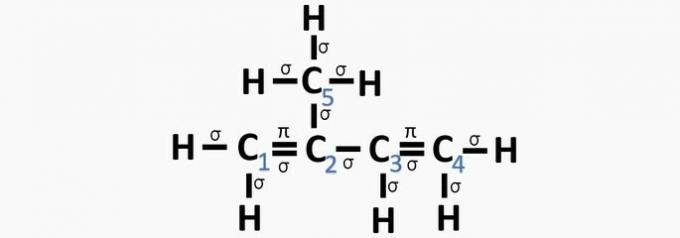
d) NAPAČNO. Sp hibridizacija se pojavi, kadar med ogljikom obstaja trojna ali dve dvojni vezi.
e) NAPAK. Ogljik nima sp hibridizacije4 in sp hibridizacija nastopi, kadar med ogljiki obstaja trojna ali dve dvojni vezi.
4. vprašanje
(UFF) Obstaja plinasti vzorec, ki ga tvori ena od naslednjih spojin: CH4; Ç2H4; Ç2H6; Ç3H6 ali C3H8. Če 22 g tega vzorca zasede prostornino 24,6 L pri tlaku 0,5 atm in temperaturi 27 ° C (Glede na: R = 0,082 L .atm. K–1.mol–1), se sklene, da gre za plin:
a) etan.
b) metan.
c) propan.
d) propen.
e) eten.
Pravilna alternativa: c) propan.
1. korak: pretvorite temperaturno enoto iz Celzija v Kelvin.
2. korak: izračunajte število molov spojine z uporabo splošne plinske enačbe.
3. korak: izračunajte molsko maso spojine.
4. korak: poiščite ogljikovodik z molsko maso 44 g / mol.
Metan
Ethene
Etan
propilen
Propan
Tako se sklene, da je plin, ki ustreza informacijam v izjavi, propan.
5. vprašanje
(ITA) Upoštevajte naslednje snovi:
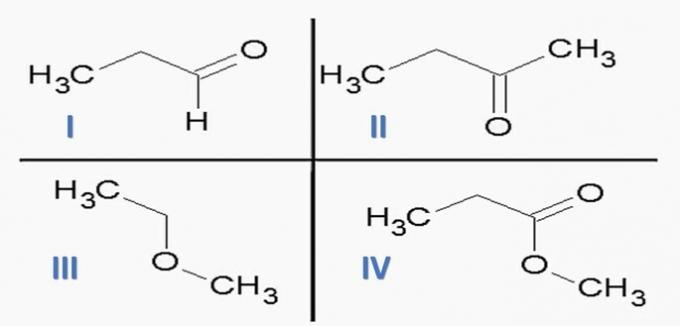
in naslednje kemijske funkcije:
The. karboksilna kislina;
B. alkohol;
ç. aldehid;
d. keton;
in. ester;
f. eter.
Možnost, ki PRAVILNO poveže snovi s kemičnimi funkcijami, je:
pomoč; IIc; IIIe; IVf.
b) Ic; IId; IIIe; DDV
c) Ic; IId; IIIf; IVe.
d) Id; IIc; IIIf; IVe.
e) Ia; IIc; IIIe; IVd.
Pravilna alternativa: c) Ic; IId; IIIf; IVe.
Organske funkcije določajo strukture in združujejo organske spojine s podobnimi značilnostmi.
Kemijske funkcije, ki so prisotne v alternativah, so:
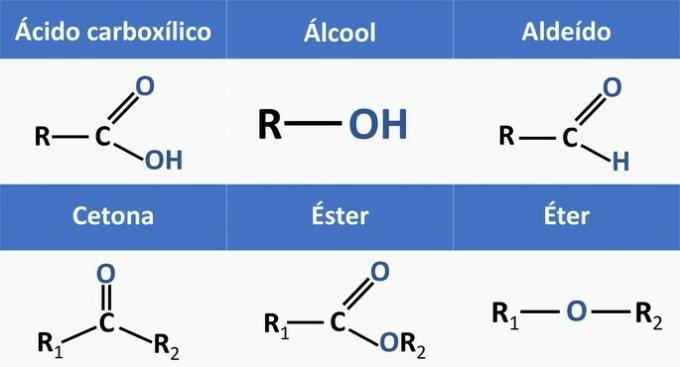
Če analiziramo zgornje strukture in spojine, ki so prisotne v izjavi, imamo:
a) NAPAK. Delovanje organov je pravilno, vendar je zaporedje napačno.
b) NAPAK. Med spojinami ni karboksilne kisline.
c) PRAVILNO. Funkcionalne skupine, prisotne v spojinah, predstavljajo naslednje kemijske funkcije.

d) NAPAČNO. I je aldehid, II pa keton.
e) NAPAK. Med spojinami ni karboksilne kisline.
Več o tem na: Organske funkcije.
Vprašanja o vragu
Vprašanje 1
(Enem / 2014) Ena metoda za določanje vsebnosti etanola v bencinu je mešanje znanih količin vode in bencina v določeni steklenici. Po stresanju bučke in čakanju, da se določen čas izmeri količina dobljenih dveh ne mešanih faz: ene organske in druge vodne. Etanol, ki se nekoč meša z bencinom, se zdaj meša z vodo.
Za razlago vedenja etanola pred in po dodajanju vode je treba vedeti
a) gostoto tekočin.
b) velikost molekul.
c) vrelišče tekočin.
d) atomi, prisotni v molekulah.
e) vrsta interakcije med molekulami.
Pravilna alternativa: e) vrsta interakcije med molekulami.
Medmolekularne sile vplivajo na topnost organskih spojin. Snovi se ponavadi topijo med seboj, kadar imajo enako medmolekularno silo.
V spodnji tabeli si oglejte nekaj primerov organskih funkcij in vrste interakcij med molekulami.
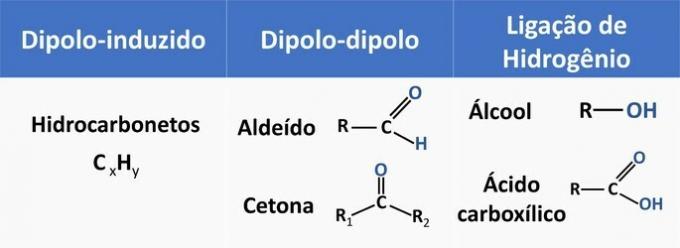
Etanol velja za polarno topilo, saj ima v svoji strukturi polarno skupino (—OH). Vendar je njegova ogljikova veriga, ki je nepolarna (CH), sposobna interakcije z nepolarnimi topili. Zato se etanol topi v vodi in v bencinu.
Glede na te podatke imamo:
a) NAPAK. Gostota poveže maso telesa z zasedeno prostornino.
b) NAPAK. Velikost molekul vpliva na polarnost spojin: večja je ogljikova veriga, bolj nepolarna postane snov.
c) NAPAK. Vrelišče je uporabno za ločevanje molekul: destilacija ločuje spojine z različnimi vrelišči. Nižje kot je vrelišče, lažje je uparjanje molekule.
d) NAPAČNO. Aldehid ima v svoji strukturi ogljik, vodik in kisik. Ta spojina izvaja dipol-dipolne interakcije, medtem ko alkohol z enakimi elementi lahko tvori vodikove vezi.
e) PRAVILNO. Interakcija etanola z vodo (vodikova vez) je intenzivnejša kot pri bencinu (diplo-inducirano).
2. vprašanje
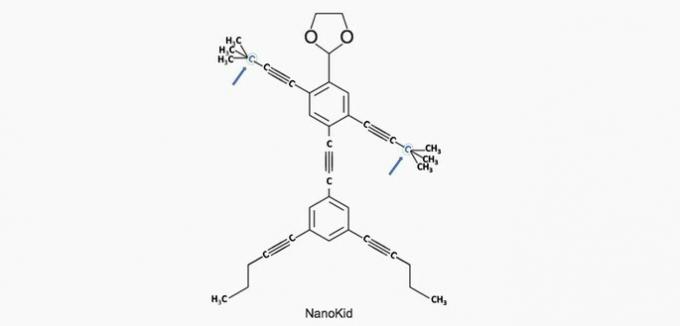
(Enem / 2013) Molekule nanoputijci spominjajo na človeške figure in so bile ustvarjene za spodbujanje zanimanja mladih za razumevanje jezika, izraženega v strukturnih formulah, ki se pogosto uporabljajo v organski kemiji. Primer je NanoKid, predstavljen na sliki:
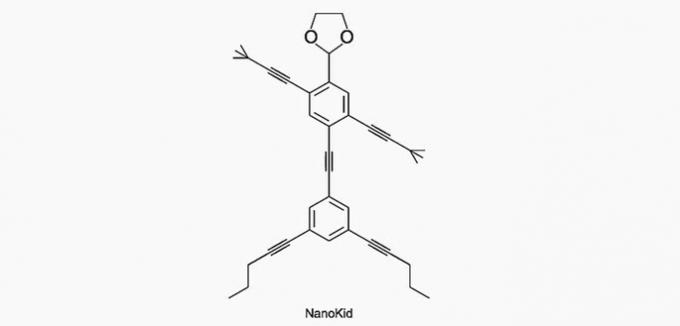
Kje v telesu NanoKida je kvaternarni ogljik?
a) Roke.
b) Glava.
c) Skrinja.
d) trebuh.
e) Stopala.
Pravilna alternativa: a) Roke.
Ogljik je razvrščen na naslednji način:
- Primarno: veže se na ogljik;
- Sekundarno: veže se na dva ogljika;
- Terciarno: veže se na tri ogljike;
- Kvartar: veže se na štiri ogljike.
Oglejte si spodnje primere.

Glede na te podatke imamo:
a) PRAVILNO. Ogljik v roki je vezan na štiri druge ogljike, zato je kvaternar.
b) NAPAK. Glava je sestavljena iz primarnih ogljikov.
c) NAPAK. Skrinja je sestavljena iz sekundarnih in terciarnih ogljikov.
d) NAPAČNO. Trebuh je sestavljen iz sekundarnih ogljikov.
e) NAPAK. Stopala so narejena iz primarnih ogljikov.
3. vprašanje
(Enem / 2014) Nekaterih polimernih materialov ni mogoče uporabiti za izdelavo določenih vrst artefaktov, niti za omejitve mehanskih lastnosti bodisi zaradi enostavnosti razgradnje, ki povzročajo za to neželene stranske proizvode aplikacijo. Zato je pregled pomemben za določitev narave polimera, uporabljenega pri izdelavi artefakta. Ena od možnih metod temelji na razgradnji polimera, da nastanejo monomeri, ki so mu nastali.
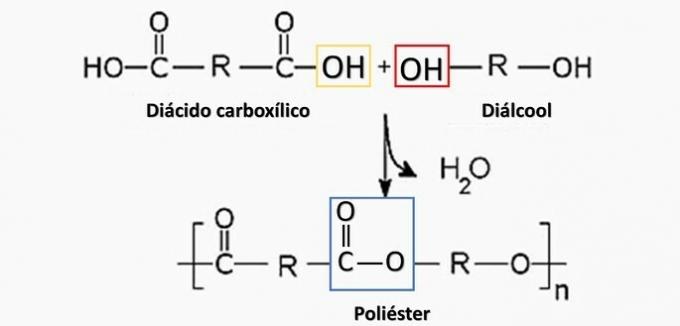
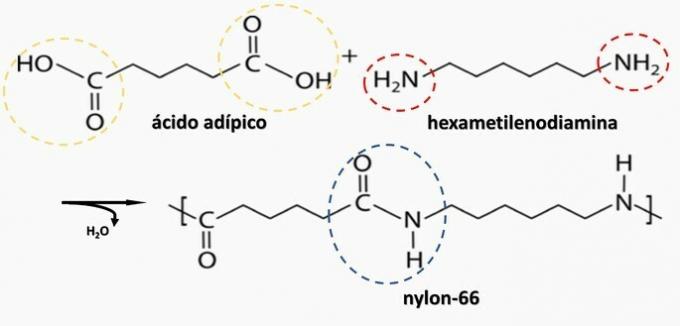
Nadzorovana razgradnja artefakta, ki ustvarja diamin H2N (CH2)6NH2 in HO kislino2C (CH2)4CO2H. Zato je bil artefakt narejen iz
a) poliester.
b) poliamid.
c) polietilen.
d) poliakrilat.
e) polipropilen.
Pravilna alternativa: b) poliamid.
a) NAPAK. Poliester nastane v reakciji med dikarboksilno kislino (-COOH) in dialkoholom (-OH).
b) PRAVILNO. Poliamid nastane s polimerizacijo dikarboksilne kisline (-COOH) z diaminom (-NH2).
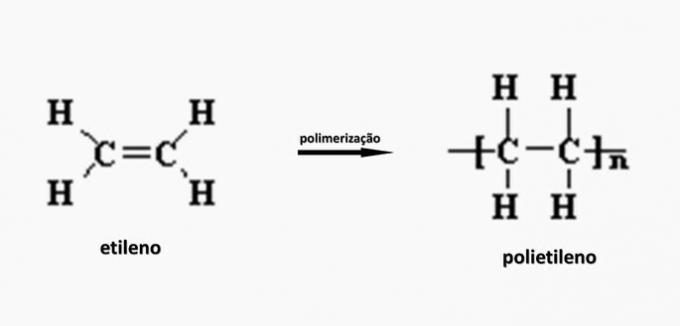
c) NAPAK. Polietilen nastane pri polimerizaciji etilen monomera.
d) NAPAČNO. Poliakrilat tvori sol, pridobljena iz karboksilne kisline.
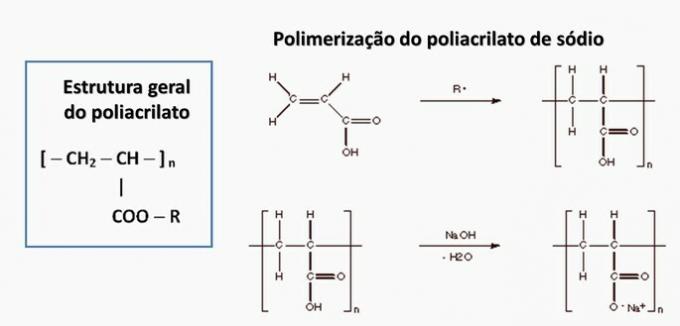
e) NAPAK. Polipropilen nastane pri polimerizaciji propilenskega monomera.
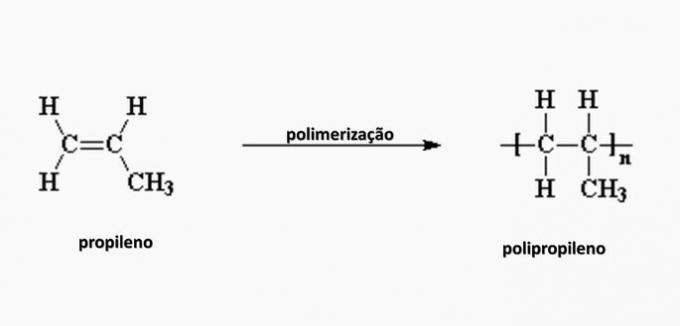
4. vprašanje
(Enem / 2008) Kitajska se je zavezala, da bo odškodovala Rusijo za razlitje benzena iz industrije Kitajska petrokemikalija v reki Songhua, pritoku reke Amur, ki je del meje med obema držav. Predsednik ruske Zvezne agencije za vodne vire je zagotovil, da benzen ne bo prišel do cevovodov pitno vodo, vendar je prebivalstvo pozval, naj zavre tekočo vodo in se izogiba ribolovu v reki Amur in njeni pritoki. Lokalne oblasti hranijo na stotine ton premoga, saj mineral velja za učinkovit absorber benzena. Internet: (s prilagoditvami). Ob upoštevanju ukrepov, sprejetih za zmanjšanje škode za okolje in prebivalstvo, je pravilno, da to trdimo
a) premog, ko ga damo v vodo, reagira z benzenom in ga izloči.
b) benzen je hlapnejši od vode, zato ga je treba prevreti.
c) usmerjenost k izogibanju ribolovu je posledica potrebe po konzerviranju rib.
d) benzen ne bi onesnažil cevi za pitno vodo, saj bi bil naravno odtočen na dnu reke.
e) onesnaževanje zaradi razlitja benzena v kitajski industriji bi bilo omejeno na reko Songhua.
Pravilna alternativa: b) benzen je hlapnejši od vode, zato ga je treba prevreti.
a) NAPAK. Premog v svoji strukturi vsebuje več por in se uporablja kot adsorbent, saj je sposoben komunicirati s kontaminanti in jih zadržati na svoji površini, ne pa jih odpraviti.
b) PRAVILNO. Večja kot je hlapnost snovi, lažje se spremeni v plinasto stanje. Medtem ko je vrelišče vode 100 ° C, benzena 80,1 ° C. To je zato, ker je voda polarna spojina, benzen pa nepolarna spojina.
Vrsta interakcij molekul je različna in vpliva tudi na vrelišče snovi. Molekula vode je sposobna tvoriti vodikove vezi, vrsta interakcije, ki je veliko močnejša od tiste, ki jo benzen z induciranim dipolom lahko tvori.
c) NAPAK. V prehranjevalni verigi eno bitje postane hrana drugega glede na interakcije vrst na določenem območju. Ko se strupena snov sprosti v okolje, se postopoma kopičijo in ribe onesnažen, ko ga človek zaužije, lahko s seboj vzame benzen in povzroči mutacije DNK in celo celo raka.
d) NAPAČNO. Benzen ima nižjo gostoto kot voda. Tako je trend, da se tudi pod vodo še naprej širi.
e) NAPAK. Sezonske spremembe lahko še povečajo težavo, saj nizke temperature zmanjšajo biološko sposobnost razgradnje kemikalij z delovanjem sonca ali bakterij.
5. vprašanje
(Enem / 2019) Ogljikovodiki so organske molekule z vrsto industrijskih aplikacij. Na primer, v velikih količinah so prisotni v različnih naftnih frakcijah in jih običajno ločimo z frakcijsko destilacijo glede na njihovo temperaturo vrelišča. V tabeli so predstavljene glavne frakcije, pridobljene pri destilaciji nafte pri različnih temperaturnih območjih.
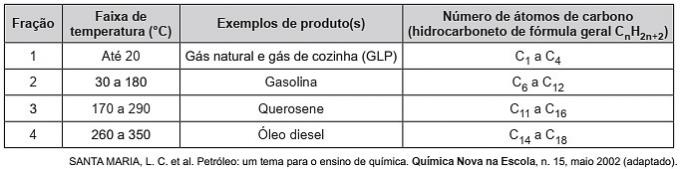
V frakciji 4 pride do ločevanja spojin pri višjih temperaturah, ker
a) njihove gostote so večje.
b) število vej je večje.
c) njegova topnost v olju je večja.
d) medmolekularne sile so močnejše.
e) ogljikovo verigo je težje prekiniti.
Pravilna alternativa: d) medmolekularne sile so močnejše.
Ogljikovodiki sodelujejo z induciranim dipolom in ta vrsta medmolekularne sile se poveča s povečanjem ogljikove verige.
Zato imajo težje naftne frakcije višjo temperaturo vrelišča, saj verige močneje vplivajo z induciranim dipolom.
Za več vaj s komentirano ločljivostjo glejte tudi:
- Vaje na ogljikovodikih
- Vaje o organskih funkcijah
- Vprašanja o kemiji v Enem


