Izhlapevanje gre za prehod iz tekočega v plinasto stanje. Pojavlja se na prosti površini tekočin, počasi in postopoma, pri kateri koli temperaturi.
Ko je snov v tekočem stanju, ima med atomi nižjo kohezijsko silo kot v trdnem stanju.
V tem stanju so molekule še bolj narazen, v stalnem mešanju in se gibljejo znotraj tekočine z različnimi hitrostmi.
Na ta način delci z večjo hitrostjo, ko dosežejo prosto površino tekočine, uspejo pobegniti in preiti v plinasto stanje.

Hitrost izparevanja
Obstajajo dejavniki, ki vplivajo na hitrost izhlapevanja, in sicer:
- Temperatura: višja je temperatura, hitrejša je hitrost izhlapevanja. Ker višja je temperatura, višja je kinetična energija delcev. Na ta način bo s površine tekočine ušlo več delcev.
- Narava tekočine: obstajajo snovi, ki lažje izhlapijo, imenujemo jih hlapne snovi. Eter, alkohol in aceton so primeri hlapnih snovi.
- prosta površina: ker izhlapevanje poteka na prosti površini tekočin, večja je površina, večja je količina delcev, ki bodo zapustili tekočino.
- Koncentracija hlapov v tekočini: večja je količina pare, nižja je hitrost izhlapevanja.
- Pritisk na tekočino: višji kot je tlak, nižja je hitrost izhlapevanja.
Razlika med izhlapevanjem in vrenjem
Tako izhlapevanje kot Vreti predstavljajo spremembo iz tekočega v plinasto stanje. Medtem ko izhlapevanje poteka postopoma, se vrenje zgodi hitro.
Da pride do vrenja, mora tekočina pri določenem tlaku doseči določeno temperaturo, imenovano vrelišče. Izhlapevanje se lahko zgodi pri kateri koli temperaturi.
Ločevanje zmesi
Frakcijska kristalizacija je postopek ločevanja heterogenih zmesi. Uporablja se, kadar so snovi, ki sestavljajo zmes, v trdnem stanju.
V tem postopku se mešanici doda tekočina, ki raztopi vse trdne sestavine. Nato komponente po izhlapevanju raztopine kristalizirajo ločeno.
Ta postopek se na primer uporablja v solinah za pridobivanje soli iz morske vode.

Izhlapevanje in vodni cikel
Izhlapevanje je eden od procesov, ki tvorijo vodni krog. Sončna energija ogreva prosto površino jezer, rek, morij in oceanov.
To ogrevanje povzroči, da del vode izhlapi v parno stanje. Ta se po doseganju najvišjih plasti ozračja ohladi in zgosti v oblake.
Ko pride do padavin, se voda vrne na površino v tekoči obliki, prodre v tla in tvori podzemne plošče.
Del te vode absorbirajo rastline, ki s transpiracijo vrnejo vodno paro v ozračje.
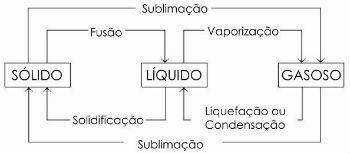
fazne spremembe
Splošno se imenuje prehod iz tekočega v plinasto stanje izhlapevanje, saj poleg izhlapevanja zajema še dva procesa: vrenje in segrevanje.
Obstajajo še drugi procesi spremembe stanja. Ali so:
- Fuzija
- Utrjevanje
- Utekočinjenje ali kondenzacija
- Sublimacija
V spodnjem diagramu predstavljamo tri fizikalna stanja snovi in ustrezne spremembe stanja:
Več o tem na: Spremembe fizičnega stanja.



