Ogljikovodiki so spojine, ki jih tvorita samo ogljik in vodik s splošno formulo: CxHy.
Gre za obsežno količino snovi, med katerimi so najbolj znane sestavine nafte in zemeljskega plina.
Hrbtenico ogljikovodika tvori ogljik in nato vodikovi atomi preko kovalentne vezi.
Veliko se uporabljajo v kemični industriji in so med drugim bistveni pri proizvodnji naftnih derivatov: goriv, polimerov, parafina.
Lastnosti ogljikovodikov
| molekularna interakcija | So praktično nepolarne spojine in njihovim molekulam se pridruži inducirani dipol. |
|---|---|
| Tališče in vrelišče | V primerjavi s polarnimi spojinami so nizke. |
| agregacijskih stanj |
|
| Gostota | Imajo manjšo gostoto kot voda. |
| Topnost | So netopni v vodi in topni v nepolarnih snoveh. |
| Reaktivnost |
|
Razvrstitev ogljikovodikov
Kar zadeva obliko glavne ogljikove verige, so ogljikovodiki razvrščeni v:
alifatski ogljikovodiki
Nastanejo iz odprtih ali acikličnih ogljikovih verig, ki imajo končne ogljike.
- alkani
- alkeni
- Alkini
- Alkadienes
Primer:
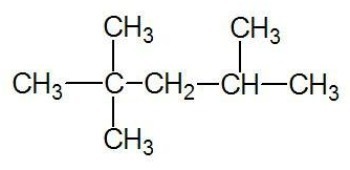
Glej tudi: ogljikove verige
Ciklični ogljikovodiki
Nastanejo iz zaprtih ali cikličnih ogljikovih verig, ki nimajo končnih ogljikov.
- Ciklani
- Cikli
- kolesarji
- Aromatika
Primeri:
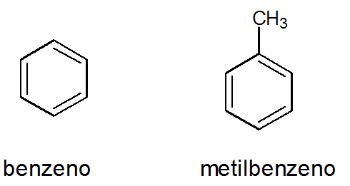
Glej tudi: benzen
Kar zadeva vezi ogljikovih verig, bodisi enojne, dvojne ali trojne:
Nasičeni ogljikovodiki
Spojine tvorijo enojne vezi med atomi ogljika in vodika.
- alkani
- Ciklani
Primer:
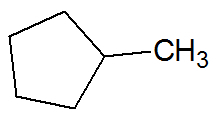
nenasičeni ogljikovodiki
Nastale spojine imajo dvojne ali trojne vezi med atomi ogljika in vodika.
- alkeni
- Alkini
- Alkadienes
- Cikli
- kolesarji
- Aromatika
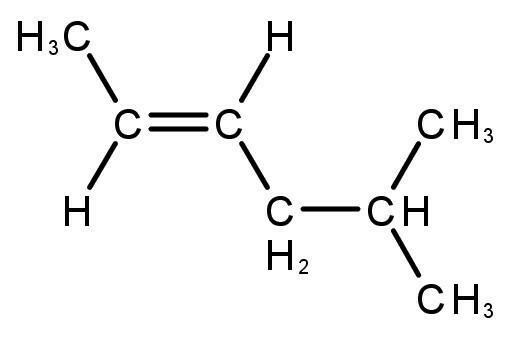
Preberite tudi o:
- Kemične vezi
- Organska kemija
- Organske funkcije
Nomenklatura
Nomenklatura ogljikovodikov je opredeljena z naslednjimi izrazi:
| PREDNOS | POSREDNIŠTVO | PREDLOGA |
|---|---|---|
| Označuje število ogljikov v verigi. | Vrsta povezave v nizu. | Identifikacija funkcionalne skupine. |
| PREDNOS | POSREDNIŠTVO | PREDLOGA | ||
|---|---|---|---|---|
| 1C | SREČAL | Samo ena povezava | AN | O |
| 2C | ET | |||
| 3C | PROP | dvojno vez | SL | |
| 4C | AMPAK | |||
| 5C | PENT | dve dvojni vezi | DIEN | |
| 6C | ŠEST | |||
| 7C | HEPT | trojna povezava | IN |
|
| 8C | OKT | |||
| 9C | NE | Dve trojni povezavi | DIIN | |
| 10C | DEC |
Primeri
Sledite, kako nastajajo imena ogljikovodikov:
| Etan |
- Predpona: ET, kar ustreza 2 ogljikom.
- Posrednik: AN, kar ustreza posameznim povezavam.
- Pripona: O, kar ustreza funkciji ogljikovodikov.
Oglejte si druge primere:
| Propan | |
| Ethene | |
| Etino | |
| propadien |
V nekaterih primerih je treba navesti položaj dvojne ali trojne vezi. Številčenje se mora začeti od najbližjega konca te povezave.
| 1,3-butadien | |
| 1-butin |
Več o tem na:
- Butan
- Metan
Vrste ogljikovodikov
Oglejte si glavne vrste ogljikovodikov, njihove značilnosti in uporabljene spojine:
alkani
So ogljikovodiki z odprto verigo z enojnimi vezmi med atomi ogljika in vodika, katerih splošna formula je ÇštH2n + 2.
Značilnosti alkanov
- Imenujejo se tudi parafini ali parafini.
- V naravi jih najdemo v zemeljskem plinu in nafti.
- Uporabljajo se kot gorivo: kuhalni plin, bencin, dizelsko olje itd.
Primeri alkanov

alkeni
So ogljikovodiki z odprto verigo in imajo dvojno vez, katerih splošna formula je ÇštH2n.
Značilnosti alkenov
- Imenujemo jih tudi olefini, alkeni ali etilenski ogljikovodiki.
- Industrijsko so pridobljeni s krekingom alkanov, ki so prisotni v nafti.
- Uporabljajo se kot surovina v industriji: plastika, barvila, eksplozivi itd.
Primeri alkenov

Alkini
So ogljikovodiki z odprto verigo s prisotnostjo dvojne vezi, katerih splošna formula je ÇštH2n-2.
Značilnosti alkinov
- Zaradi trojne vezi so bolj reaktivni kot alkani in alkeni.
- Alkini z več kot 14 atomi ogljika so trdni.
- Najbolj uporabljen alkin je acetilen, ki se pogosto uporablja pri proizvodnji sintetičnih kavčukov, tekstilnih vlaken in plastike.
Primeri alkinov

Alkadienes
So ogljikovodiki z odprto verigo in prisotnost dveh dvojnih vezi, katerih splošna formula je ÇštH2n-2
Značilnosti alkadienov
- Imenujemo jih tudi dieni ali diolefini
- V naravi jih najdemo v terpenih, ki jih pridobivamo iz esencialnih sadnih olj.
- Najbolj znana spojina je izopren, ki ga najdemo v naravni gumi in eteričnih oljih.
Primeri alkadienov

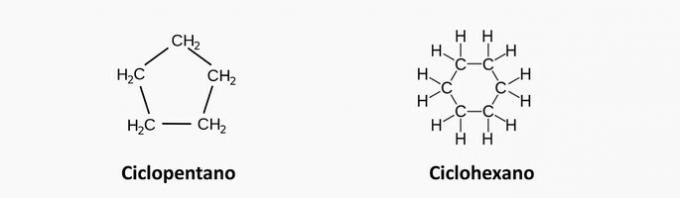
Ciklani
So ogljikovodiki z zaprto verigo z enojnimi vezmi med atomi ogljika in vodika, katerih splošna formula je ÇštH2n.
Značilnosti cikla
- Imenujemo jih tudi cikloalkani ali cikloparafini.
- Ko so pod visokim pritiskom, so nestabilni.
- Verige z več kot 6 ogljiki so stabilne, verige z manj kot 5 ogljiki pa reaktivne.
Primeri ciklanov

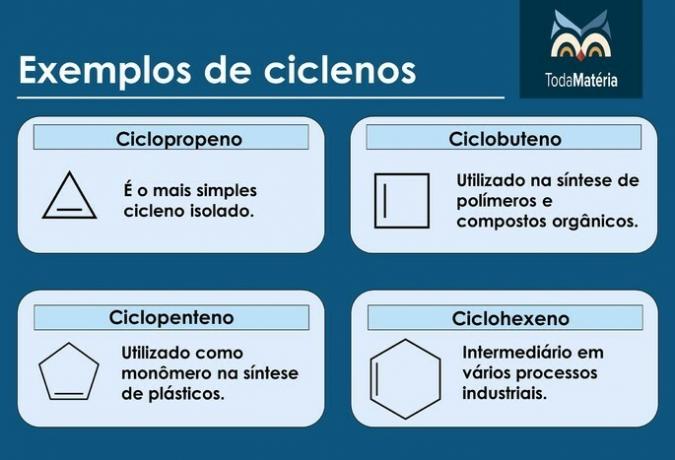
Cikli
So ogljikovodiki z zaprto verigo s prisotnostjo dvojne vezi, katere strukturna formula je ÇštH2n-2.
Značilnosti ciklov
- Imenujejo se tudi cikloalkeni.
- Spojine s 3 do 5 ogljiki so nestabilne.
- Običajno jih najdemo v zemeljskem plinu, nafti in nafti.
Primeri ciklov
kolesarji
So ogljikovodiki z zaprto verigo s prisotnostjo trojne vezi, katere strukturna formula je ÇštH2n-4.
Značilnosti kolesarjenja
- Imenujemo jih tudi cikloalkini ali cikloalkini.
- So ciklični in nenasičeni ogljikovodiki.
- Zaradi trojne vezi so nestabilne in jih v naravi ni.
Primeri ciklinov

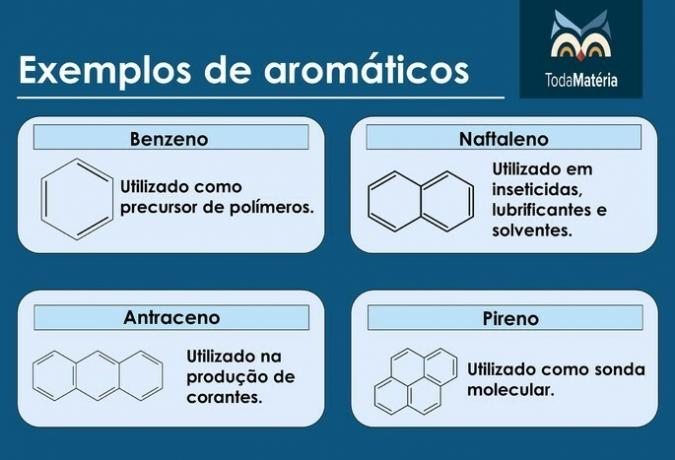
Aromatika
So zaprti verižni ogljikovodiki z izmeničnimi enojnimi in dvojnimi vezmi.
Značilnosti aromatikov
- Imenujejo se tudi arene.
- So nenasičene spojine, saj imajo 3 dvojne vezi.
- Sestavljeni so iz vsaj enega aromatičnega obroča.
Primeri aromatičnih snovi
- Nafta
- rafiniranje nafte
- Acetilen
Povzetek ogljikovodikov
| Poklic | Splošna formula |
Lastnosti |
|---|---|---|
| alkan | Odprta veriga s preprostimi členi. |
|
| alken | Odprta veriga z dvojno vezjo. | |
| alkin | Odprta veriga s trojno vezjo. | |
| alkadiene | Odprta veriga z dvema dvojnima vezema. | |
| Ciklani | Zaprta veriga s preprostimi povezavami. | |
| Cikli | Zaprta veriga z dvojno vezjo. | |
| kolesarji | Zaprta veriga s trojno povezavo. | |
| Aromatičen | Spremenljiv | Zaprta veriga z izmeničnimi enojnimi in dvojnimi vezmi. |
Vaje na ogljikovodikih
1. (UEMA) Utekočinjeni naftni plin (utekočinjeni naftni plin), znan tudi kot kuharski plin, je gorivo neobnovljivi fosil, ki ga lahko čez noč zmanjka, če se ne uporablja načrtovano in brez njega presežek. Sestavljen je med drugimi plini iz propana C.3H8, butan C4H10 in majhne količine propilena C3H6 in buten C4H8. Te organske spojine so razvrščene kot ogljikovodiki, ki imajo med seboj podobnosti in razlike. Glede na vrsto vezi med ogljiki in klasifikacijo ogljikove verige zgornjih spojin lahko ugotovimo, da:
a) nenasičeni spojini sta propan in butan.
b) nenasičene spojine sta propen in buten.
c) nenasičene spojine sta propen in butan.
d) spojine imajo homociklične verige.
e) spojine imajo heterociklične verige.
Alternativa b) nenasičene spojine sta propen in buten.
a) NAPAK. Te spojine nimajo nenasičenosti, njihove vezi so preproste.
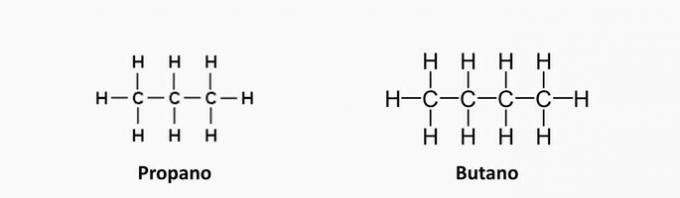
b) PRAVILNO. Izraz "en" označuje prisotnost dvojnih vezi v spojinah.

c) NAPAK. Butan nima nenasičenj.

d) NAPAK. Te verige so zaprte, ogljikovi atomi pa so povezani z enojnimi vezmi.
e) NAPAK. Te verige imajo heteroatom, kot sta kisik in dušik.

2. (Uel) Eden od ogljikovodikov s formulo C.5H12 ima lahko ogljikovo verigo:
a) nasičena ciklična.
b) heterogeni aciklični.
c) razvejano ciklično.
d) nenasičena odprta.
e) odprto razvejano.
Alternativa e) odprto razvejano.
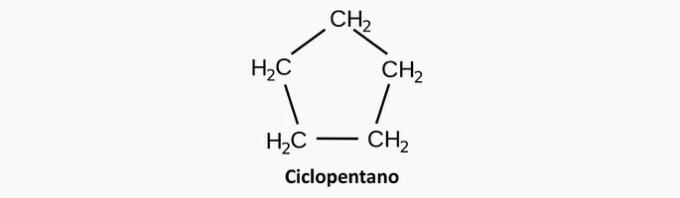
a) NAPAK. Nasičena ciklična spojina ustreza ciklanu, katerega formula je CštH2n.
Primer:
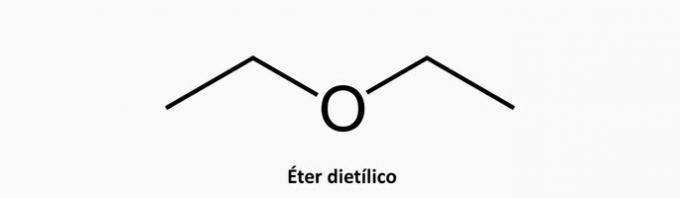
b) NAPAK. Heterogena aciklična spojina ima poleg interkaliranega ogljika v verigi še en element.
Primer:
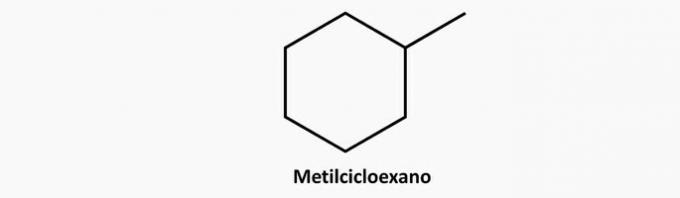
c) NAPAK. Razvejana ciklična spojina ima formulo CštH2n.
Primer:
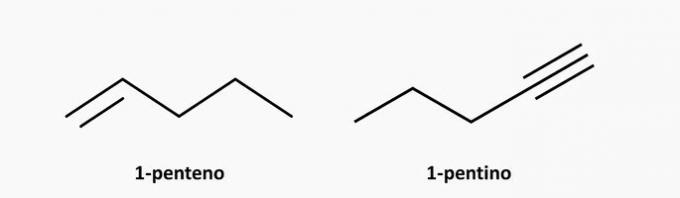
d) NAPAK. Nenasičena spojina z odprto verigo je lahko alken ali alkin, katere formula je C.štH2n in C.štH2n-2.
Primeri:
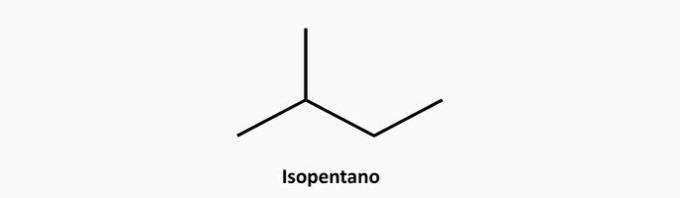
e) PRAVILNO. Razvejana razvejana spojina je alkan, katerega formula je CštH2n + 2. Spojina s 5 ogljiki in 12 vodiki bi lahko bila izopentan.
Primer:
3. (PUC) Alkini so ogljikovodiki:
a) nasičene alifatike.
b) nasičene aliciklike.
c) nenasičene alifatike z dvojno vezjo.
d) nenasičene aliciklike s trojno vezjo.
e) trojno vezane nenasičene alifate.
Alternativa e) nenasičene alifate s trojno vezjo.
a) NAPAK. Odprte in enovezane spojine so alkani.
Primer:

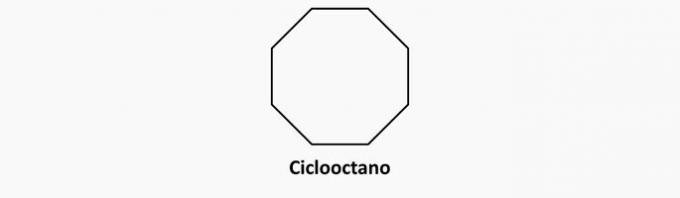
b) NAPAK. Ciklične spojine z enojnimi vezmi so ciklani.
Primer:
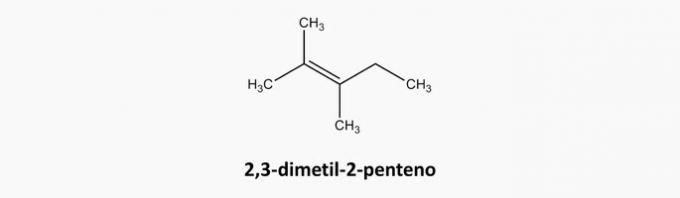
c) NAPAK. Spojine z odprto verigo in dvojno vezjo so alkeni.
Primer:
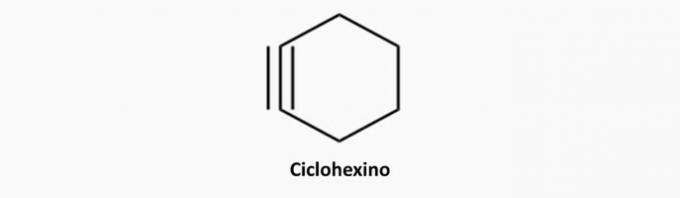
d) NAPAK. Ciklične in trojne vezi so ciklini.
Primer:
e) PRAVILNO. Alkini so spojine z odprto verigo in trojno vezjo.

Ali želite še naprej preizkušati svoje znanje? Preverite te sezname:
- Vaje na ogljikovodikih
- Vaje iz organske kemije
- Vaje o organskih funkcijah


