opredeljuje kot hibridizacija združitev nepopolnih atomskih orbital. Orbitala je razvrščena kot nepopolna, če ima samo eno elektrona v njej namesto dveh. Glej prikaz nepopolne in popolne orbite:

Na sliki A imamo popolno orbitalo; na sliki B nepopolna orbitala.
Hibridizacija je naravni pojav, ki se pojavi z nekaterimi kemičnimi elementi, kot so fosfor, žveplo, ogljik itd. Hibridizacija ogljika omogoča, da lahko atomi tega elementa tvorijo štiri kemične vezi, kar pomeni, da ogljik naredi štiri vezi šele po pojavu hibridizacije.
Toda zakaj se ogljik hibridizira in tvori štiri vezi? Da bi razumeli ta pojav, moramo poznati elektronsko distribucijo tega elementa:
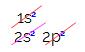
Pri elektronski porazdelitvi ogljika vidimo, da je podnivo 1s popolno (z dvema elektronoma), 2s pa popolna (z dvema elektronoma) in podnivo 2p je nepopolno (podnivo p podpira šest elektronov, vendar obstaja le dva). Če reprezentante 2p porazdelimo na reprezentativen način, moramo:
Ne ustavi se zdaj... Po oglaševanju je še več;)
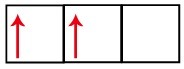
P podnivo ima tri orbitale - pri ogljiku sta dve nepopolni, ena pa prazna. Iz tega razloga mora ta element izvajati le dve povezavi, saj število nepopolnih orbital vedno določa število povezav.
Pri sprejemanju energije iz zunanjega okolja pa se elektroni v ogljiku vzbudijo. Tako se eden od elektronov, prisotnih v podnivoju 2s, premakne na prazno orbitalo podnivoja p:
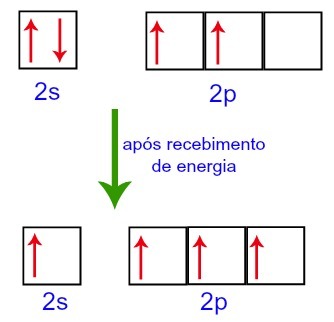
Ogljikove orbitale pred in po prejemu energije iz zunanjega okolja
Tako ostanejo ogljiku na drugi ravni štiri nepopolne orbitale. Nato se orbitala 2s pod nivojem združi s tremi p orbitalami, kar konfigurira pojav hibridizacija.
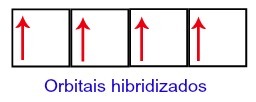
Orbitale ogljika po hibridizaciji
Jaz, Diogo Lopes Dias
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
DNI, Diogo Lopes. "Hibridizacija ogljika"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/hibridizacao-carbono.htm. Dostopno 28. junija 2021.