* Arrenijeva teorija:
Na podlagi njegovih eksperimentov z električno prevodnostjo v vodnih medijih, kemijskih, fizikalnih in matematičnih Šved Svante August Arrhenius (1859-1927) je leta 1884 predlagal naslednje koncepte za opredelitev kislin in osnove:

Tako imamo na splošno:
H+ + H2O → H3O+
Primeri:
HCl + H2O → H3O++ Kl-
HNO3+ H2O → H3O+ + NE3-
H2SAMO4+ 2H2O → 2H3O+ + OS42-

Primeri:
NaOH → Na + + OH-
Ca (OH)2 → Ca2+ + 2 OH-
* Brönsted-Lowryjeva teorija:
Neodvisno Danski Johannes Nicolaus Brönsted (1879-1947) in Anglež Thomas Martin Lowry (1874-1936), istega leta predlagal še eno kislinsko-bazično teorijo, znano kot Brönsted-Lowryjeva teorija, ki pravi, da Sledi:

V tem primeru se vodikov ion šteje za proton. To se vidi v naslednji reakciji, kjer cianovodikova kislina donira proton vodi, ki torej deluje kot baza:
HCN + H2O → CN- + H3O+
Ta reakcija je reverzibilna z vodikovim ionom (H3O+) lahko donira proton ionu CN-. Tako hidronijev ion (H3O+) deluje kot kislina in CN- kot osnova.
CN- + H3O+→ HCN + H2O
* Lewisova teorija:
To teorijo je ustvaril ameriški kemik Gilbert Newton Lewis (1875-1946) in pravi naslednje:

Ta teorija uvaja nov koncept, je bolj celovita, vendar ne razveljavi Brönsted-Lowryjeve teorije. Vsaka Lewisova kislina je Brönstedova kislina, zato je vsaka Lewisova baza Brönstedova baza. To je zato, ker proton sprejema elektrone, kar pomeni, da se Lewisova kislina lahko pridruži osamljenemu paru elektronov v Lewisovi bazi.
Za Lewisa kislo-bazična reakcija sestoji iz tvorbe stabilnejše koordinirane kovalentne vezi. Torej, ko Lewisova baza donira par elektronov Lewisovi bazi, oba tvorita a koordinatna kovalentna vez, v kateri oba elektrona prihajata iz enega od atomov, kot v primeru spodaj:
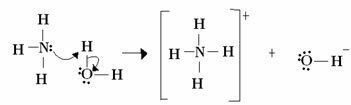
V tem primeru amoniak deluje kot Lewisova in Brönstedova baza, saj protonu donira svoja dva elektrona in je zato sprejemnik protona. Poleg tega je med vodikom (protonom) in amoniakom nastala kovalentna vez.
Voda je Lewisova kislina in Brönstedova kislina, saj donira proton in sprejema elektrone, opazi, kako ima kisik v hidroksidu, ki nastane iz vode, dodaten par elektronov.

Avtorica Jennifer Fogaça
Diplomiral iz kemije
Brazilska šolska ekipa.
Vir: Brazilska šola - https://brasilescola.uol.com.br/quimica/teorias-acidobase-arrheniusbronstedlowry-lewis.htm
