Eden od načinov organiziranja kemičnih elementov je prek družin, ki ustrezajo navpičnim zaporedjem periodnega sistema.
Ob 18 stolpcev tabele razvrsti elemente glede na podobnosti v kemijskih lastnostih.
Organizacija kemičnih elementov v družine je bil praktičen način za strukturiranje različnih najdenih informacij in njihovo predstavitev na preprost način.
Za lažjo umestitev kemičnega elementa so bile družine označene s številkami od 1 do 18, kot sledi:
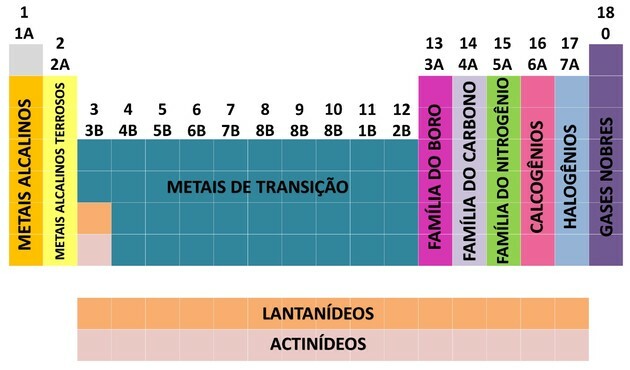
S prispevki mnogih znanstvenikov in različnimi poskusi urejanja podatkov se je periodni sistem razvil in vzpostavil red za razporeditev elementov.
Nomenklatura družin
- Družine v tabeli so bile razdeljene na A (reprezentativne) in B (prehodne), ki so bile označene s črkami in številkami.
- Ti reprezentativni elementi družine 0, 1A, 2A, 3A, 4A, 5A, 6A in 7A ustrezajo.
- Ti prehodni elementi družine 1B, 2B, 3B, 4B, 5B, 6B, 7B in 8B ustrezajo.
- Z določitvijo Mednarodne zveze za čisto in uporabno kemijo (IUPAC) so bile družine identificirane v Ljubljani skupine od 1 do 18.
Periodni sistem in elektronska distribucija
Podobnosti med elementi iste družine se pojavijo, ker je število valentnih elektronov atoma v osnovnem stanju enako za člane določene skupine.
Na primer:
| 1. skupina | Eletronska distribucija |
|---|---|
| 3preberite | 2-1 |
| 11Ob | 2-8-1 |
| 19K | 2-8-8-1 |
| 37Rb | 2-8-18-8-1 |
| 55Cs | 2-8-18-18-8-1 |
| 87Fr | 2-8-18-32-18-8-1 |
Atomi skupine 1 imajo svoje elektrone porazdeljene na več kot en nivo energije, vsi pa imajo valenčni elektron.
S tem opažamo, da je izdelava elektronska distribucija atoma v osnovnem stanju najdemo njegov položaj na periodnem sistemu.
reprezentativni elementi
Reprezentativni elementi kažejo razmeroma manj zapleteno kemijsko vedenje kot prehodni elementi in tvorijo večino snovi okoli nas.
Nekatere reprezentativne družine elementov dobijo posebna imena, kot je prikazano spodaj:
Skupina |
Družina | določeno ime | Izvor imena | Elementi | elektronska konfiguracija |
|---|---|---|---|---|---|
| 1 | 1A | alkalne kovine | iz latinščine alkalije, kar pomeni “siva rastlina”. | Li, Na, K, Rb, Cs in Fr | nas1 |
| 2 | 2A | zemeljskoalkalijske kovine | Izraz "zemeljski" se nanaša na "obstoječ na zemlji". | Bodi, Mg, Ca, Sr, Ba in Ra | nas2 |
| 13 | 3A | družina bora | Ime prvega elementa družine. | B, Al, Ga, In, Tl in Nh. | nas2np1 |
| 14 | 4A | ogljikova družina | Ime prvega elementa družine. | C, Si, Ge, Sn, Pb in Fl. | nas2np2 |
| 15 | 5A | Družina dušika | Ime prvega elementa družine. | N, P, As, Sb, Bi in Mc. | nas2np3 |
| 16 | 6A | Halkogeni | iz grškega khalks, saj gre za elemente, ki jih najdemo v bakrenih rudah. | O, S, Se, Te, Po in Lv. | nas2np4 |
| 17 | 7A | Halogeni | Grški izraz, ki pomeni oblikovalce soli. | F, Cl, Br, I, At in Ts. | nas2np5 |
| 18 | 0 | Plemeniti plini | Štelo se je, da ne reagira z drugimi snovmi. | On, Ne, Ar, Kr, Xe, Re in Og. | 1s2 (On) ali mi2np6 |
Skozi tabelo lahko vidimo, da:
- Zgoraj predstavljeni elementi so razvrščeni kot reprezentativni, ker imajo najbolj energijski elektron v podnivu s ali p.
- Elektroni so porazdeljeni po nivojih energije in n predstavlja najbolj zunanjo raven atoma v osnovnem stanju.
- Reprezentativni elementi po priporočilu IUPAC spadajo v skupine ali družine 1,2,13,14,15,16,17 in 18.
O vodik razvrščena je ločeno od ostalih elementov. Tudi z elektronsko konfiguracijo 1s1, ni del skupine 1 zaradi predstavitve edinstvenega vedenja.
prehodni elementi
Prehodni elementi ustrezajo skupinam od 3 do 12. To ime dobijo, ker imajo vmesne značilnosti med skupinama 1 in 2 in reprezentativnimi nekovinskimi elementi.
Ti prehodne kovine jih IUPAC opredeljuje kot:
Prehodni element ima nepopolno d podnivo ali lahko tvori katione z nepopolnim d podnivojem.
Ko je najbolj energičen elektron atoma v osnovnem stanju v nepopolnem podnivu, je to označeno kot zunanji prehod.
Lantanidi in aktinidi so notranji prehodni elementi, saj imajo vsaj eno nepopolno podnivo.
Ko imajo elementi elektrone, ki zapolnjujejo d ali f orbitale, imajo podobne lastnosti in jih je mogoče razvrstiti v elemente zunanji ali notranji prehod.
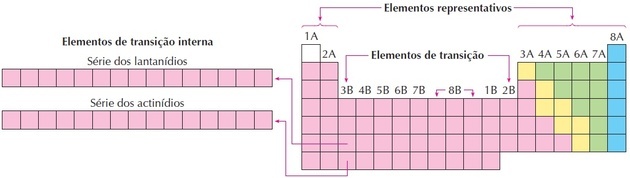
Kot lahko vidimo na sliki, družina 8B ustreza 3 stolpcem, gre za skupine 8, 9 in 10, ki so bile tako razvrščene, ker imajo podobne značilnosti.
Glavne značilnosti družin
Spodnja tabela prikazuje glavne lastnosti skupin v periodnem sistemu:
| Skupina | Lastnosti | sestavljene snovi bolj pogosto |
pojavov |
|---|---|---|---|
| 1 | Trdna in sijoča v okolju. Zelo reaktivni, mehki in dobri vodniki električne energije. | Soli, hidroksidi in oksidi |
Reagirajte s halogeni in tvorite soli. |
| 2 | Manj reaktivni in težji od skupine 1. Trdne snovi srebra z dobro prevodnostjo. | Soli, hidroksidi in oksidi |
Tvorba soli in oksidov. |
| 3 do 12 | Tvorijo komplekse. So kovinske trdne snovi, trde in krhke, z izjemo živega srebra, ki je tekočina. | Soli, oksidi in kompleksi. Na primer: AgNO3, TiO in [Cr (OH)3(H2O)3] |
V mineralih v obliki oksidov. |
| 13 | Trdne snovi v okolju, srebro, razen bora. | Oksidi Na primer: B2O3 |
V mineralih v obliki oksidov. |
| 14 | Trdno v okolju. | Atoma C in Si se lahko razporedita v verige in tvorita ogromno različnih snovi. | V živih organizmih in v obliki silikatov ali oksidov. |
| 15 | Trdne snovi, razen dušika, ki je plinast v okolju. | Oksidi in kisline Na primer: NE2 in H3PRAH4 |
Vzdušje, živi organizmi in minerali. |
| 16 | Trdne snovi, razen kisika, ki je plinast v okolju. | Sulfidi in oksidi Primer: ZnS in SiO2 |
Vzdušje, živi organizmi in minerali. |
| 17 | Tvorijo dvoatomske molekule in so zelo reaktivne. So slabi prevodniki električne energije in toplote. So agresivni do živih bitij in okolja. | Kisline in soli. Na primer: HCl in KBr |
So prisotne v snoveh organske in mineralne. |
| 18 | So zelo stabilni in jih najdemo v obliki plinov. | Težko tvorijo sestavljene snovi. | Plini v ozračju. |
Kemijske in fizikalne lastnosti ločujejo eno družino od druge. Kot smo videli, so kemijske lastnosti povezane z elektroni valence, prek njih pa atom sodeluje z drugim, odgovoren je za kemijsko vedenje in kemijske vezi oblikovan.
Fizične lastnosti elementov v isti skupini se lahko razlikujejo glede na atomsko število in maso.
Vaje
Zdaj, ko veste nekaj več o družinah periodnega sistema, preizkusite svoje znanje in preverite, kaj ste se naučili.
1) Razmislite o naslednjem izvlečku iz periodnega sistema.
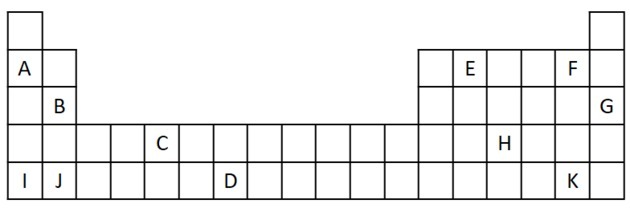
a) Poimenuj dva elementa, ki imata dva valenčna elektrona.
b) Označite element, ki burno reagira z vodo in povzroči kovinski hidroksid.
c) Navedite nereaktivni element.
d) Navedite dva elementa, ki skupaj z alkalijskimi kovinami tvorijo soli.
Odgovor:
a) B in J
Dva valentna elektrona ustrezata skupini 2, ki ima ns elektronsko konfiguracijo2 in jih v vaji zastopata B in J.
b) A, B, I ali J.
A in I predstavljata elemente družine 1; B in J sta iz družine 2. Kot smo videli v tabeli lastnosti, sta elementa skupine 1 in 2 zelo reaktivna in lahko tvorita hidrokside, kot v danih primerih: KOH in Mg (OH)2.
c) G
Plemeniti plini so zelo stabilni in zato premalo reaktivni. Črka G je v tabelo vstavljena kot element te družine.
d) F in K
Halogeni reagirajo z alkalnimi kovinami in tvorijo soli. Najpogostejši primer tega je kuhinjska sol, NaCl.
2) Naslednja slika prikazuje tri kemijske elemente, od leve proti desni, litij, natrij in kalij.

Izberite možnost, ki pravilno dopolnjuje vsakega od naslednjih stavkov.
1.1) "Lahko rečemo, da litij, natrij in kalij ...
(A)... spadajo v isto obdobje. "
(B)… ima enako atomsko številko. "
(C)… pripadajo isti skupini. "
(D)… ima enako masno število. "
1.2) "Elementi litij, natrij in kalij ...
(A)… ima zelo podobne kemijske lastnosti. "
(B)… ima zelo različne kemijske lastnosti. "
(C)… so nekovine. "
(D)… reagirajte z vodo, da nastanejo kisle raztopine. "
Odgovori:
1.1) (C) spadajo v isto skupino.
1.2) (A) ima zelo podobne kemijske lastnosti.
Te informacije lahko dobimo z uporabo periodične tabele ali z elektronsko distribucijo elementov litij, natrij in kalij. Videli bomo, da imajo trije elektron v valentni lupini in ker so del iste skupine, so si kemijske lastnosti zelo podobne.
3) Upoštevajte naslednjo tabelo, kjer so predstavljena atomska števila in elektronske porazdelitve nekaterih kemičnih elementov.
| Element | kemični simbol | atomsko število | Eletronska distribucija |
|---|---|---|---|
| Litij | preberite | 3 | 2,1 |
| Berilij | biti | 4 | 2,2 |
| Fluor | F | 9 | 2,7 |
| neon | Huh | 10 | 2,8 |
| klor | Kl | 17 | 2,8,7 |
| argon | Zrak | 18 | 2,8,8 |
| Kalij | K | 19 | 2,8,8,1 |
| Kalcij | Tukaj | 20 | 2,8,8,2 |
Navedite skupino vsakega elementa.
Odgovor:
Litij in kalij: skupina 1. (V valentni lupini imajo elektron).
Berilij in kalcij: skupina 2. (V valentni lupini imajo dva elektrona).
Fluor in klor: skupina 17. (V valentni lupini imajo sedem elektronov).
Neon in argon: skupina 18. (V valentni lupini imajo osem elektronov).
Vprašanja za sprejemni izpit preverite s komentarjem v Vaje na periodnem sistemu in neobjavljena vprašanja na to temo v Vaje za urejanje periodnega sistema.