Francoski kemik Joseph Louis Proust (1754-1826) je nadaljeval z natančnimi poskusi, ki so se nanašali na mase komponent nekaterih reakcij.
Na primer, elementi, ki tvorijo vodo, so vodik in kisik. Proust je ugotovil, da je v tej reakciji tvorjenja vode vodik vedno reagiral s kisikom v stalnem in določenem razmerju, ki je bilo 1: 8. Oglejte si, kako se to zgodi spodaj:

Opazite to ne glede na to, koliko mase uporabljenih elementov bo delež vedno enak.
Proust je opozoril, da ni šlo le za vodo, temveč za vse druge snovi.
15,06 g bakrovega sulfida (CuS) nastane na primer z reakcijo 10,00 g kovinskega bakra (Cu) s 5,06 g žvepla (S). Torej, če podvojimo količino bakra (ki bo znašala 20,0 g) in če želimo, da ves baker reagira, prav tako bo treba količino žvepla podvojiti na 10,12 g, s skupno tvorbo 30,12 g sulfid.
Zdaj, če dodamo znesek, ki ni v sorazmerju, bo presežni znesek ostal, ne bo reagiral. Upoštevajte to spodaj:
Ne ustavi se zdaj... Po oglaševanju je še več;)
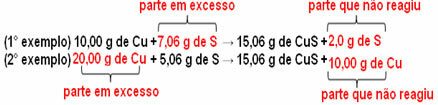
Opazite to reakcija poteka le v skladu z določenim razmerjem
. Zato je Proust leta 1799 sklenil, da ko se več snovi združi in tvori spojino, se to vedno naredi v določenem razmerju mase.Tako je ustvaril zakon, ki se imenuje Proustov zakon, Zakon konstantnih proporcij ali Zakon določenih proporcij, ki je navedeno na naslednji način:

Ta zakon in Lavoisierjev zakon (Zakon o ohranjanju mase) Zakoni o teži, ker govorijo v množici vpletenih snovi.
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
FOGAÇA, Jennifer Rocha Vargas. "Proustov zakon ali zakon konstantnih proporcij"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/lei-proust-ou-lei-das-proporcoes-constantes.htm. Dostop 27. junija 2021.

