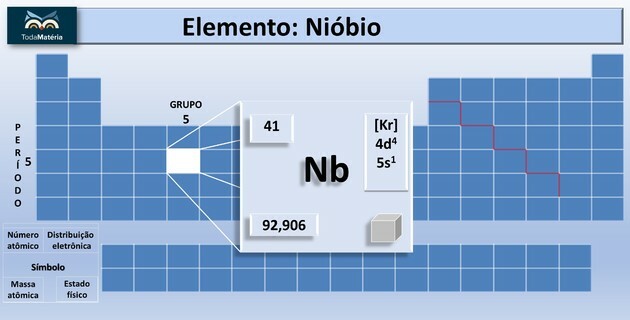
Niobij (Nb) je kemični element atomskega števila 41, ki spada v skupino 5 periodnega sistema.
To je naravno dostopna prehodna kovina v trdnem stanju, ki jo je leta 1801 odkril britanski kemik Charles Hatchett.
Minerali, ki vsebujejo niobij, so na svetu redki, vendar jih je v Braziliji, državi z največjimi zalogami te kovine, veliko.
Zaradi svojih lastnosti, visoke prevodnosti in odpornosti proti koroziji ima ta element številne namene, od proizvodnje jekla do proizvodnje raket.
Nato bomo predstavili ta kemični element in značilnosti, zaradi katerih je tako pomemben.
Kaj je niobij?
Niobij je ognjevzdržna kovina, to je zelo odporen na toploto in obrabo.
Kovine v tem razredu so: niobij, volfram, molibden, tantal in renij, niobij pa je najlažji od vseh.
Niobij se v naravi pojavlja v mineralih, ki so običajno povezani z drugimi elementi, predvsem tantalom, saj imata zelo podobne fizikalno-kemijske lastnosti.
Ta kemični element je na periodnem sistemu razvrščen kot prehodna kovina. Je svetel, nizke trdote, z nizko odpornostjo proti prehodu električnega toka in odporen proti koroziji.
Fizikalne lastnosti niobija
| fizično stanje | trdna pri sobni temperaturi |
|---|---|
| barva in videz | kovinsko siva |
| Gostota | 8,570 g / cm3 |
| Fuzijska točka | 2468 ° C |
| Vrelišče | 4742 ° C |
| Kristalna struktura | Body Centered Cubic - CCC |
toplotna prevodnost |
54,2 W m-1 K-1 |
Kemijske lastnosti niobija
| Razvrstitev | prehodna kovina |
|---|---|
| atomsko število | 41 |
| Blokiraj | d |
| Skupina | 5 |
| Časovni potek | 5 |
| atomska teža | 92,90638 u |
| atomski žarek | 1,429 Å |
| skupni ioni | Opomba5+ in Nb3+ |
| elektronegativnost | 1.6 Pauling |
Glavna prednost uporabe te kovine je, da lahko le ta količina v gramih spremenite tono železa, tako da je kovina lažja, odporna proti koroziji in še več učinkovito.
Kje je najden Niobij?
V primerjavi z drugimi snovmi, ki so prisotne v naravi, ima niobij nizko koncentracijo v deležu 24 delov na milijon.
To kovino najdemo v naslednjih državah: Brazilija, Kanada, Avstralija, Egipt, Demokratična republika Kongo, Grenlandija, Rusija, Finska, Gabon in Tanzanija.
Niobij v Braziliji
V petdesetih letih je brazilski geolog Djalma Guimarães v Braziliji odkril največje nahajališče rude piroklora, ki vsebuje to kovino.
Velika količina rud, ki vsebujejo niobij, se nahaja v Braziliji, največji svetovni proizvajalki, ki ima več kot 90% zalog kovine.
Raziskane rezerve se nahajajo v zveznih državah Minas Gerais, Amazonas, Goiás in Rondônia.
rude niobija
Niobij najdemo v naravi, ki je vedno povezan z drugimi kemičnimi elementi. Znanih je že več kot 90 mineralnih vrst, ki vsebujejo niobij in tantal v naravi.
V spodnji tabeli lahko vidimo nekatere rude, ki vsebujejo niobij, glavne značilnosti in vsebnost niobija, ki je na voljo v posameznem materialu.
| kolumbitni tantalit | |
|---|---|
 | |
| Sestava: | (Fe, Mn) (Nb, Ta)2O6 |
| Vsebnost niobija (največ): | 76% Nb2O5 |
| Lastnosti: |
|
| Piroklorit | |
|---|---|
 | |
| Sestava: | (Ob2, Tukaj)2(Nb, Ti) (O, F)7 |
| Vsebnost niobija (največ): | 71% Nb2O5 |
| Lastnosti: |
|
| Loparit | |
|---|---|
 | |
| Sestava: | (C, Na, C)2(Ti, Nb)2O6 |
| Vsebnost niobija (največ): | 20% Nb2O5 |
| Lastnosti: |
|
raziskovanje niobija
Rude niobija se pretvarjajo, dokler ne nastanejo proizvodi, ki se bodo tržili.
Korake postopka lahko povzamemo kot:
- Rudarstvo
- Koncentracija niobija
- Rafiniranje niobija
- Izdelki iz niobija
Rudarstvo poteka tam, kjer so zaloge rude, ki se pridobivajo z eksplozivi in prevažajo s pasovi do mesta koncentracije.
Koncentracija nastane z razgradnjo rude, mletje povzroči, da se kristali rude postanejo bolj drobni in z uporabo magnetno ločevanje frakcije železa se odstranijo iz rude.
Pri rafiniranju niobija se odstranjujejo žveplo, voda, fosfor in svinec.
Eden od izdelkov, ki vsebujejo niobij, je zlitina železa in niobija, ki se proizvaja v skladu z naslednjo enačbo:
Ta postopek se imenuje aluminotermija, pri katerem koncentrat rude mešajo v reaktorjih z ostanki železa ali železovega oksida.
Kovinski oksidi reagirajo z aluminijem pri visokih temperaturah in tvorijo izdelek, ki nas zanima.
Najbolj komercializirani izdelki iz niobija so:
- Koncentrati niobija: osnova, ki vsebuje 58% Nb2O5.
- Zlitina železa in niobija: vsebuje 65% niobija.
- Oksid visoke čistosti: uporablja se pri proizvodnji posebnih materialov.
Za kaj je niobij?
Zaradi lastnosti niobija je ta element vedno bolj zaželen in z neštetimi aplikacijami.
Od njegovega odkritja leta 1905 so začeli raziskovati uporabe niobija, ko je nemški kemik Werner von Bolton element ustvaril v čisti obliki.
Petdeseta leta so predstavljala odlično iskanje aplikacij niobija, saj do takrat niso nastajali v velikem obsegu.
V tem obdobju je hladna vojna sprožila zanimanje za to kovino, ki se bo uporabljala v vesoljskih komponentah.
Spodaj je seznam načinov uporabe niobija.
Kovinske zlitine

Dodatek niobija zlitini poveča njeno trdoto, to je sposobnost strjevanja, ko je izpostavljena vročini in nato ohlajena. Tako lahko material, ki vsebuje niobij, podvržemo posebnim toplotnim obdelavam.
Afiniteta niobija z ogljikom in dušikom daje prednost mehanskim lastnostim zlitine, kar povečuje na primer mehansko trdnost in odpornost na abrazivno obrabo.
Ti učinki so koristni, saj lahko razširijo industrijsko uporabo zlitine.
Jeklo je na primer kovinska zlitina, ki jo tvorijo železo in ogljik. Dodatek niobija tej zlitini ima lahko prednosti za:
- Avtomobilska industrija: izdelava avtomobila lažji in bolj odporen na trke.
- Gradnja: izboljšuje varljivost jekla in zagotavlja gibljivost.
- Industrija transportnih cevovodov: Omogoča konstrukcije s tanjšimi stenami in večjimi premeri, ne da bi to vplivalo na varnost.
super zlitine

Superzlitina je kovinska zlitina z visoko odpornostjo na visoke temperature in mehansko trdnost. Zlitine, ki vsebujejo niobij, naredijo ta material uporaben pri izdelavi letalskih turbin ali pri proizvodnji energije.
Prednost delovanja pri visokih temperaturah omogoča, da super zlitine sestavljajo visoko zmogljive reaktivne motorje.
superprevodni magneti

Zaradi superprevodnosti niobija se spojine niobij-germanij, niobij-skandij in niobij-titan uporabljajo v:
- Skener MRI naprav.
- Pospeševalniki delcev, kot je Veliki hadronski trkalnik.
- Odkrivanje elektromagnetnega sevanja in proučevanje kozmičnega sevanja z materiali, ki vsebujejo niobij nitrit.
Oksidi
Druge aplikacije niobija so v obliki oksidov, predvsem Nb2O5. Glavne uporabe so:
- optične leče
- Keramični kondenzatorji
- pH senzorji
- deli motorja
- Nakit
Zgodovina in odkritje Niobija
Leta 1734 so nekatere rude iz osebne zbirke Johna Winthropa odnesli iz Amerike v Anglijo in ti predmeti so bili del zbirke Britanskega muzeja v Londonu.
Britanski kemik Charles Hatchett se je po vstopu v Royal Society osredotočil na raziskovanje sestave rud, ki so na voljo v muzeju. Tako je leta 1801 izoliral kemični element v obliki oksida in ga poimenoval kolumbij in ruda, iz katere je bil pridobljen kolumbit.
Leta 1802 je švedski kemik Anders Gustaf Ekeberg poročal o odkritju novega kemičnega elementa in ga poimenoval tantal, glede na Zevsovega sina v grški mitologiji.
Leta 1809 je angleški kemik in fizik William Hyde Wollaston analiziral ta dva elementa in ugotovil, da imata zelo podobne lastnosti.
Zaradi tega sta bila od leta 1809 do 1846 kolumbij in tantal enaka elementa.
Pozneje je nemški mineralog in kemik Heinrich Rose, ki je preiskal rudo kolumbita, ugotovil, da je prisoten tudi tantal.
Rose je ugotovil prisotnost drugega elementa, podobnega tantalu, in ga poimenoval Niobius, v zvezi z Niobo, hčerjo Tantala, iz grške mitologije.
Leta 1864 je Šved Christianu Bromstrandu uspelo izolirati niobij iz vzorca klorida, segretega v vodikovi atmosferi.
Leta 1950 je zveza čiste in uporabne kemije (IUPAC) kot uradno ime odobrila niobij in ne kolumbij, saj sta bila isti kemični element.
Povzetek niobija
Kemični element: Niobij | |||
|---|---|---|---|
| Simbol | Opomba | Odkrivalec | Charles Hatchett |
| atomsko število | 41 | atomska masa | 92.906 u |
| Skupina | 5 | Časovni potek | 5 |
| Razvrstitev | prehodna kovina | Eletronska distribucija | [Kr] 4d35s2 |
| Lastnosti |
|
||
| Glavne rude |
|
||
| Glavni proizvodi |
|
||
| aplikacij |
|
||
| Pojav | Na svetu |
|
|
| V Braziliji |
|
Enemove vaje in sprejemni izpiti
1. (Enem / 2018) V grški mitologiji je bila Niobija hči Tantala, dveh likov, znanih po svojem trpljenju. Kemični element z atomskim številom (Z), ki je enak 41, ima kemijske in fizikalne lastnosti tako podobne elementu z atomskim številom 73, da so bili zmedeni.
Zato so v počastitev teh dveh likov v grški mitologiji ti elementi dobili ime niobij (Z = 41) in tantal (Z = 73). Ta dva kemična elementa sta dobila velik gospodarski pomen v metalurgiji, pri proizvodnji superprevodnikov in v drugih vrhunskih industrijskih aplikacijah, ravno zaradi kemijskih in fizikalnih lastnosti skupna obema.
KEAN, S. Izginjajoča žlica: in druge resnične zgodbe o norosti, ljubezni in smrti zaradi kemičnih elementov. Rio de Janeiro: Zahar, 2011 (prilagojeno).
Ekonomski in tehnološki pomen teh elementov je zaradi podobnosti njihovih kemijskih in fizikalnih lastnosti posledica
a) imajo elektrone v spodnjem nivoju.
b) kot elementi notranjega prehoda.
c) pripadajo isti skupini na periodnem sistemu.
d) imajo najbolj oddaljene elektrone na nivojih 4 oziroma 5.
e) biti v družini zemeljskoalkalijskih in alkalnih družin.
Pravilna alternativa: c) pripadajo isti skupini na periodnem sistemu.
Periodična tabela je organizirana v 18 skupin (družin), kjer vsaka skupina združuje kemijske elemente s podobnimi lastnostmi.
Te podobnosti se zgodijo, ker imajo elementi skupine enako število elektronov v valentni lupini.
Z elektronsko porazdelitvijo in dodajanjem elektronov iz najbolj energetskega podniveja v najbolj zunanji podnivo najdemo skupino, ki ji pripadata elementa.
| Niobij | |
|
Porazdelitev elektronika |
1s2 2 s2 2p6 3s2 3p6 4s2 3d10 4p65s2 4d3 |
|
vsota elektroni |
bolj energičen + bolj zunanji 4d3 + 5s2 = 5 elektronov |
| Skupina | 5 |
| Tantal | |
|
Porazdelitev elektronika |
1s2 2 s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p66s2 4f145d3 |
|
vsota elektroni |
bolj energičen + bolj zunanji 5d3 + 6s2 = 5 elektronov |
| Skupina | 5 |
Elementa niobij in tantal:
- Spadajo v isto skupino na periodnem sistemu.
- Svoje najbolj oddaljene elektrone imajo na nivojih 5 oziroma 6 in se nahajajo v 5. in 6. obdobju.
- V spodnjem nivoju imajo elektrone in so zato prehodni elementi zunaj.
2. (IFPE / 2018) Brazilija je največja svetovna proizvajalka niobija, saj predstavlja več kot 90% zaloge te kovine. Niobij, simbol Nb, se uporablja pri proizvodnji posebnih jekel in je ena najbolj odpornih kovin na korozijo in ekstremne temperature. Spojina Nb2O5 je predhodnica skoraj vseh zlitin in niobijevih spojin. Označite alternativo z zahtevano maso Nb2O5 da dobimo 465 gramov niobija. Glede na to: Nb = 93 g / mol in O = 16 g / mol.
a) 275 g
b) 330 g
c) 930 g
d) 465 g
e) 665 g
Pravilna alternativa: e) 665 g
Predhodna spojina niobija je Nb oksid2O5 in niobij, uporabljen v zlitinah, je v elementarni obliki Nb.
Zato imamo naslednje stehiometrično razmerje:
1 mol Nb2O5 tvori 2 mola Nb, saj niobij oksid tvorita 2 atoma te kovine.
1. korak: izračunamo število molov proizvedenega niobija, ki ustreza 465 g.
Če smo z izračunom videli, da masa niobija ustreza 5 molom, potem je število molov Nb2O5 je polovica te vrednosti, ker:
2. korak: izračunamo molsko maso niobijevega oksida.
3. korak: izračunajte maso niobijevega oksida, ki ustreza 2,5 mola.
3. (UECE / 2015) Brazilija ima 98% svetovnih zalog niobija, ki ima številne industrijske namene, na primer v proizvodnji nakita, hiperalergenski vsadki, elektrokeramika, superprevodni magneti, stroji za magnetno resonanco, kovinske zlitine, posebni kovanci in pri izdelavi jeklo. Za niobij preglejte spodnje trditve in označite edino pravo alternativo.
a) Njegov diferencialni elektron se nahaja v predzadnji lupini.
b) Je reprezentativni element.
c) Njegova elektronegativnost je nižja kot pri vanadiju.
d) Spada v četrto obdobje periodnega sistema.
Pravilna alternativa: a) Njegov diferencialni elektron se nahaja v predzadnji lupini.
Pri elektronski distribuciji niobija je mogoče videti, da se njegov diferencialni elektron nahaja v predzadnji lupini.
Ker ima diferenčni elektron v podnivu d, je zunanji prehodni element.
Ker je njegova najbolj zunanja raven v peti plasti, se niobij nahaja v petem obdobju tabele.
Elektronegativnost je lastnost, povezana z zmožnostjo elementa, da privablja elektrone, in se spreminja glede na atomski polmer: manjši je atomski polmer, večja je privlačnost za elektrone in zato večja elektronegativnost.
V tabeli z vrednostmi elektronegativnosti lahko ugotovimo, da imata niobij in vanadij vrednosti blizu 1,6 Paulinga.
4. (UEA / 2014) Naravni izotop niobija je 93Opomba Število nevtronov v tem izotopu je
a) 41.
b) 52.
c) 93.
d) 134.
e) 144.
Pravilna alternativa: b) 52.
Izotopi so atomi kemičnega elementa z različnimi masnimi števili.
Atomska masa ustreza vsoti protonov in nevtronov elementa.
Število protonov predstavlja atomsko število kemičnega elementa in se za izotope ne spremeni.
Tako pride do spremembe mase izotopov zaradi različnega števila nevtronov.
Če je atomsko število niobija 41, je število nevtronov podano z izračunom:
5. (IFMG / 2015) Kemični element niobij, Nb, je dobil ime po grški boginji Niobi. Brazilija je največja svetovna proizvajalka kovine, saj predstavlja 75% proizvodnje. Zaradi toplotne stabilnosti zlitin se niobij uporablja pri proizvodnji posebnih visokotrdnih jeklenih zlitin za motorje, pogonsko opremo in različne superprevodne materiale. Če opazujemo položaj niobija na periodnem sistemu, je pravilno trditi, da:
a) vaš najbolj energičen podnivo bo podnivo d.
b) je element iz družine alkalijskih kovin.
c) tvori ionske spojine z drugimi kovinami.
d) njegovi kationi bodo imeli atomski radij večji od čistega elementa.
Pravilna alternativa: a) vaš najbolj energičen podnivo bo podnivo d.
S pogledom na periodni sistem lahko vidimo, da je niobij označen kot zunanji prehodni element, ki spada v skupino 5 periodnega sistema, saj je njegovo najbolj energijsko podnivo d.
Te podatke lahko dobimo tudi z elektronsko distribucijo.
Ker gre za kovino, ta element kovinsko povezuje druge kovine, kot pri zlitini železo-niobij ali tudi kovalentne vezi z izmenjavo elektronov, kot v niobijevem oksidu Opomba2O5.
6. (UFSC / 2003) Niobij je leta 1801 odkril angleški kemik Charles Hatchett. Brazilija ima približno 93% svetovne proizvodnje koncentrata niobija. Največja nahajališča so v zveznih državah Minas Gerais, Goiás in Amazonas. Kovina se v glavnem uporablja za izdelavo železo-niobijevih zlitin in drugih kompleksnejših zlitin, ki so bile uporabljene pri gradnji reaktivnih pogonskih turbin, raket in vesoljskih plovil. Njeni oksidi se uporabljajo pri izdelavi svetlobnih leč za očala, fotografske kamere in drugo optično opremo. Glede na (Z = 41). Glede niobija označite PRAVILNE predloge.
(01) Ko izgubi 3 elektrone, niobij prevzame konfiguracijo kriptona.
(02) Niobij lahko tvori kovinske okside tipa M2O5 v2O3.
(04) Kemični simbol za niobij je Ni.
(08) Niobij je prehodna kovina.
(16) Zlitina železa in niobija je primer trdne raztopine.
Pravilne alternative: 02 + 08 + 16 = 26.
(01) NEPRAVILNO.
| Elementi | Eletronska distribucija |
| 36Kr | 1s2 2 s2 2p6 3s2 3p6 4s2 3d10 4p6 |
|
41Opomba 41Opomba3+ |
1s2 2 s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d3 1s2 2 s2 2p6 3s2 3p6 4s2 3d10 4p6 4p6 4d2 |
(02) PRAVILNO
Glede na oksidacijska števila 3+ in 5+ za niobij lahko tvori spojine:
| Oksidacijsko število 5+ | Oksidacijsko število 3+ |
| Opomba2O5 | Opomba2O3 |
(04) NEPRAVILNO
Ni je simbol za element nikelj. Simbol za niobij je Nb.
(08) PRAVILNO
Niobij je zunanja prehodna kovina, ki spada v skupino 5 periodnega sistema.
(16) PRAVILNO
Trdna raztopina ustreza zmesi dveh ali več komponent v isti fazi, ki je trdna in je pogosta med kovinami.
7. (UERJ / 2013) Niobij je kovina, ki jo najdemo v naravnih nahajališčih, predvsem v obliki oksidov.
V usedlini, ki vsebuje niobij z oksidacijskim številom +5, formula za prevladujoči oksid te kovine ustreza:
a) NbO5
b) Nb5O
c) Opomba5O2
d) Opomba2O5
Pravilna alternativa: d) Opomba2O5
Kisik tvori dve vezi in ima določeno oksidacijsko število, ki je 2-.
Zato se mora kisik za tvorbo niobijevega oksida vezati na 2 atoma te kovine.
Niobij ima različna oksidacijska stanja. Z oksidacijskim številom 3+ se veže na 3 kisike, z Nox 5+ pa tvori spojino: Nb2O5 pri čemer se 2 atoma niobija vežeta s 5 atomi kisika.
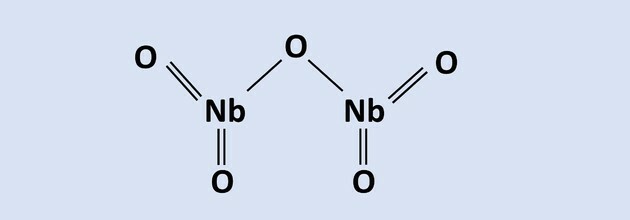
Preberite besedilo, da odgovorite na vprašanja 8 do 10.
Niobij je kovina velikega tehnološkega pomena in njegove glavne svetovne rezerve se nahajajo v
Brazilija v obliki rude piroklora, ki jo sestavljajo Nb2O5. V enem od procesov ekstraktivne metalurgije se v prisotnosti Fe oksida uporablja aluminotermija2O3, kar ima za posledico zlitino niobija in železa ter aluminijevega oksida. Reakcija tega procesa je predstavljena v enačbi:
V naravi se niobij pojavlja v obliki stabilnega izotopa niobija-93, vendar je znanih več nestabilnih sintetičnih izotopov, ki propadajo z oddajanjem sevanja. Eden izmed njih je niobij-95, ki razpade na element molibden-95.
(Systems.dnpm.gov.br; Tech. Kovina. Mater. Rudar., São Paulo, v. 6, št. 4, str. 185-191, april-junij 2010 in G. Audi idr. / Jedrska fizika A 729 (2003) 3–128. Prilagojeno)
8. (FGV / 2019) V reakciji aluminotermije za pridobitev zlitine niobija in železa, ob upoštevanju stehiometrije, predstavljene v uravnoteženi enačbi, je skupno število elektronov, vključenih v postopek,
a) 6.
b) 12.
c) 18.
d) 24.
e) 36.
Pravilna alternativa: e) 36.
Redoks reakcija se pojavi z izgubo in pridobivanjem elektronov.
Ko element zmanjša, pridobi elektrone in ko element oksidira, izgubi elektrone.
Ko element reducira, je oksidacijsko sredstvo, medtem ko kadar element oksidira, je redukcijsko sredstvo.
Na ta način je enako število elektronov, ki jih je en element izgubil, drugemu pa dal.
| Element | NOX | Reakcija | elektroni | |
| Niobij |
+5 3Opomba2O5 |
0 6Nb |
Zmanjšanje | 3.2.5 = 30 in- pridobi |
| Železo |
+3 Vera2O3 |
0 2Fe |
Zmanjšanje | 2,3 = 6 in- pridobi |
| Aluminij |
0 12Al |
+3 6Al2O3 |
Oksidacija | 6.2.3 = 36 in- izgubljeno |
Naboj aluminija na izdelku iz aluminijevega oksida je 3+, to pomeni, da je vsak aluminij izgubil 3 elektrone.
Toda v izdelkih imamo 12 atomov aluminija, kar pomeni skupno število elektronov, vključenih v postopek:
12. 3 = 36 elektronov.
9. (FGV / 2019) V postopku aluminotermije za proizvodnjo zlitine niobija in železa s stehiometričnimi količinami Nb2O5 in Fe2O3 in z uporabo presežka kovinskega aluminija je nastalo 6,12 ton Al.2O3. Skupna vsota količin niobija in železa v molih, ocenjenih za pridobitev pri tej operaciji, je
a) 6 × 104
b) 6 × 106
c) 8 × 103
d) 8 × 104
e) 8 × 106
Pravilna alternativa: d) 8 × 104.
1. korak: izračunajte molsko maso Al2O3
2. korak: izračunajte število molov Al2O3
3. korak: izvedite stehiometrične odnose.
V kemijski enačbi vidimo, da obstaja razmerje: 6 molov niobija, 6 molov aluminija in 2 mola železa.
Glede na razmerje med številom oblikovanih molov imamo:
In vsota količin niobija in železa v molih je:
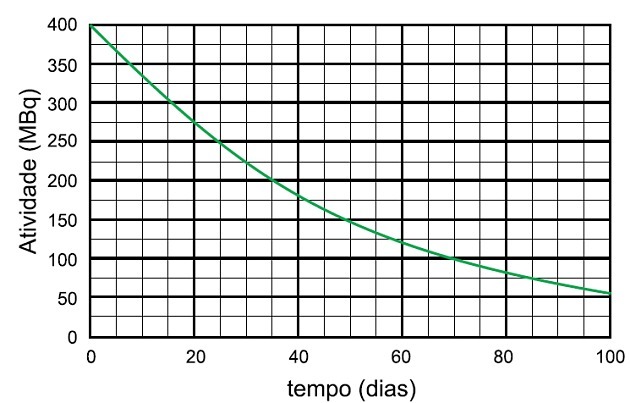
V procesu razpada radioizotopov niobija-95 sta čas, potreben za razpad aktivnosti tega vzorca na 25 MBq, in ime oddane vrste
a) 140 dni in nevtroni.
b) 140 dni in protoni.
c) 120 dni in protoni.
d) 120 dni in delci ß–.
e) 140 dni in delci ß–.
Pravilna alternativa: e) 140 dni in delci ß–.
Razpolovni čas je čas, ki je potreben, da radioaktivni vzorec prepolovi svojo aktivnost.
Na grafu vidimo, da se radioaktivna aktivnost začne pri 400 MBq, zato je razpolovni čas čas, ki je trajal, da je aktivnost razpadla na 200 MBq, kar je polovica začetne.
V grafu analiziramo, da je bil ta čas 35 dni.
Če se je aktivnost znova zmanjšala za polovico, je minilo še 35 dni in se je aktivnost premaknila z 200 MBq na 100 MBq, ko je minilo še 35 dni, torej s 400 na 100 MBq 70 dni.
Da bi vzorec razpadel do 25 MBq, so bili potrebni 4 razpolovni časi.
Kar ustreza:
4 x 35 dni = 140 dni
Pri radioaktivnem razpadu so lahko emisije alfa, beta ali gama.
Gama sevanje je elektromagnetno valovanje.
Alfa emisija ima pozitiven naboj in zmanjša 4 enote mase in 2 enoti atomskega števila razpadlega elementa in ga spremeni v drugega elementa.
Beta emisija je hitri elektron, ki poveča atomsko število razpadlega elementa za eno enoto in ga spremeni v drugega.
Niobij-95 in molibden-95 imata enako maso, zato je prišlo do emisije beta, ker:



