Ko izgovorimo besedo »ravnotežje«, mi pride na misel predmet, ki ostane za nedoločen čas. Vendar je to le ena vrsta ravnotežja, imenovano "Statično ravnovesje".
Obstaja tudi »Dinamično ravnovesje«. V njej, kot že ime pove, ni niti enega trenutka, v katerem bi bil predmet ali pojav še vedno. Na primer, da boste razumeli, glejte spodnjo sliko in upoštevajte, da je količina vode, ki pade v posodo, enaka količini, ki iz nje teče, pri čemer nivo vode ostane konstanten. V tem primeru pravimo, da obstaja dinamično ravnovesje, ravnotežje v gibanju.

Tovrstno ravnovesje se zgodi v reverzibilne reakcije, torej pri tistih reakcijah, ki se pojavijo v obe smeri. Hkrati, ko se molekule reaktantov pretvorijo v produkte, molekule produktov reagirajo med seboj in tvorijo reaktante. Reverzibilnost reakcije predstavljata puščici v obe smeri:
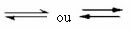
Ko je stopnja razvoja neposredne reakcije (tvorbe produktov) enaka stopnji razvoja inverzna reakcija (tvorba reaktantov) pri stalni temperaturi pomeni, da je reakcija dosegla ravnotežje kemična.
In v primeru reakcij s prisotnostjo samo molekul v reaktantih in produktih imamo a molekularno ravnovesje.Sledi primer reakcije med plinom vodika (H2) in plinski jod (I2), za tvorbo plina vodikov jodid (HI):
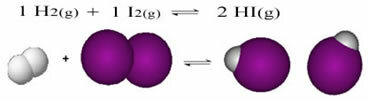
Na začetku reakcije je bila stopnja razvoja neposredne reakcije višja, saj je bila koncentracija vseh reaktantov največja, produktov pa nič. Torej je bila tudi stopnja razvoja povratne reakcije enaka nič.
Vendar sčasoma plini vodik in jod reagirajo in tvorijo produkt. Na ta način se koncentracija reagentov začne zmanjševati in tudi njihova hitrost razvoja se zmanjšuje.
Ko se koncentracija produktov povečuje in koncentracija reaktantov zmanjšuje, se stopnja razvoja inverzne reakcije začne povečevati. Če temperaturo vzdržujemo konstantno, bo prišel čas, ko bosta stopnji razvoja ostali enaki, kar bo pokazalo, da je reakcija dosegla kemijsko molekularno ravnovesje.
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Vir: Brazilska šola - https://brasilescola.uol.com.br/quimica/equilibrio-molecular.htm
