Ti oksidi sestavljena sta iz dveh različnih elementov, od katerih je eden kisik, ki mora biti najbolj elektronegativen od obeh.
Nomenklatura anorganskih oksidov sledi pravilom, ki so odvisna od tega, ali je oksid molekulski, kovalentni ali ionski. Poglejmo si vsak primer:
* Nomenklatura molekularnih oksidov ali kovalentne mreže:
Molekularni ali kovalentni mrežni oksidi so tisti, na katere je kisik pritrjen ametal, kot so ogljik (C), dušik (N), žveplo (S), fluor (F), med drugim. Nomenklatura teh oksidov sledi naslednjemu pravilu:

Pravilo nomenklature za okside, tvorjene z metali
Predpona mono pred elementom, povezanim s kisikom, ni obvezna.
Na primer, imamo naslednji molekularni oksid: CO.
- Predpona, ki označuje količino kisika: 1 kisik: mono;
- oksid;
- Predpona, ki označuje število atomov drugega elementa: 1 ogljik: mono;
- ime elementa, povezanega s kisikom: ogljik.
Torej, vaše ime je takšno: CO = monokarbonski monoksid ali ogljikov monoksid.
Oglejte si več primerov:
ogljikov dioksid - CO2
Žveplov trioksid - SO
Dikloro heptoksid - Cl2O7
Dušikov monoksid - N2O
Dušikov trioksid - N2O3
Dušikov monoksid -NO
Dušikov dioksid - NE2
Dušikov pentoksid - N2O5
Silicijev dioksid - SiO2
Difosforjev pentoksid - P2O5
Žveplov trioksid - SO3
* Nomenklatura ionskih oksidov:
Ionski oksidi so tisti, ki imajo kisik vezan na a kovine, kot so železo (Fe), svinec (Pb), natrij (Na), kalcij (Ca), srebro (Ag), med drugim. Na splošno je električni naboj kisika -2.
Nomenklatura, omenjena za molekularne ali kovalentne mrežne okside, se trenutno uporablja tudi za kovinske okside in se šteje za uradno. Oglejte si nekaj primerov:
Železov monoksid - FeO
Svinčev monoksid - PbO
Svinčev dioksid - PbO2
Različni trioksid - Fe2O3
Vendar pa obstaja posebna nomenklatura za kovinske okside, ki se še vedno pogosto uporablja. Temelji na valenci elementa, povezanega s kisikom.
Če element ima ena sama valenca, to je, če obstaja samo en način za vezavo kisika in tvorbo samo ene vrste oksida, bo pravilo poimenovanja podano z:

Pravilo imenovanja enojnih ionskih oksidov
Primeri:
- Natrijev oksid - Na2O
- kalcijev oksid - CaO
- kalijev oksid - K2O
- aluminijev oksid - al2O3
- Srebrni oksid - Ag2O
Obstajajo pa tudi ionski oksidi, ki jih tvorijo elementi z več kot eno valenco. V teh primerih je pravilo poimenovanja naslednje:
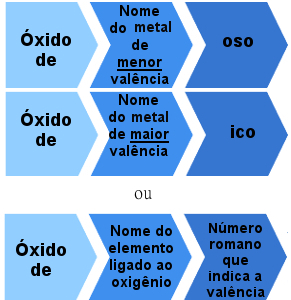
Pravilo nomenklature za ionske okside z več kot eno valenco
Primeri:
Železov oksid - FeO
Železov oksid - Fe2O3
Bakrov oksid - Cu2O
bakrovega oksida - CuO
Ali:
Železov oksid II - FeO (železov nox = +2)
Železov oksid III - Fe2O3 (Iron nox = +3).
Bakrov oksid I - Cu2O (železo nox = +1)
Bakrov oksid II - CuO (železov nox = +2).
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Vir: Brazilska šola - https://brasilescola.uol.com.br/quimica/nomenclatura-dos-oxidos.htm
