Ogljikovodiki, imenovani tudi vodikovi karbidi, so organske spojine, katerih sestava ima samo atome ogljik (C) in od vodik (H), s čimer ima splošno formulo CxHy.
Ogljikovodik je sestavljen iz ogljikove strukture, na katero so vezani vodikovi atomi kovalentna vez.
Je najpomembnejša spojina v organski kemiji.
Vse vrste ogljikovodikov zlahka oksidirajo in tako sproščajo toploto. Večina jih ni topnih v vodi.
Naravni ogljikovodiki so kemične spojine, ki nastanejo znotraj Zemlje (več kot 150 km od Ljubljane) globine) pri visokem tlaku in z geološkimi procesi dosežejo območja nižjega tlaka.
Kje najdemo ogljikovodike?
Glavni vir ogljikovodikov je nafta. Zaradi tega je ogljikovodik prisoten v več derivatih, kot so kerozin, parafin, zemeljski plin, Bencin, Vazelin, dizelsko olje, LPG (Utekočinjeni naftni plin), polimeri (na primer plastika in guma).
Ta organska spojina predstavlja 48% brazilske energijske matrike.
Ogljikova veriga, ki je del sestave ogljikovodika, je tetravalent, to pomeni, da lahko vzpostavi štiri povezave.
Ogljik se lahko veže z drugimi atomi ogljika in z vodiki skozi preproste povezave, dvojice ali trojke.
Razvrstitev ogljikovodikov
Razvrstitev ogljikovodikov temelji na treh posebnostih: a oblika glavne ogljikove verige, Povezave ogljikovih verig, prisotnost alkilnih radikalov v ogljikovi verigi in prisotnost heteroatomov delitev ogljikove verige.
vedeti več o vodik.
Oblika glavne ogljikove verige
Glede na obliko glavne ogljikove verige je razvrstitev ogljikovodikov razdeljena na alifatski in ciklično.
Preverite, iz česa je sestavljena vsaka od teh oblik ogljikove verige.
alifatski ogljikovodiki
Alifatske ogljikovodike tvorijo ogljikove verige odprto ali aciklični. V teh verigah so ogljiki terminali.
Primeri:
alkan
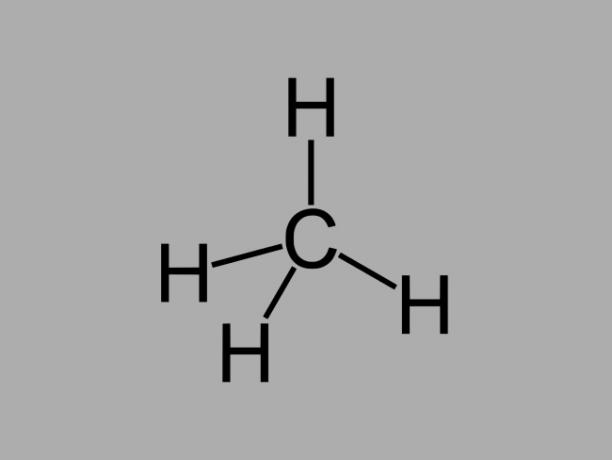
Alkanski ogljikovodiki, imenovani tudi parafini ali parafinskiso oljne spojine, pri katerih med ogljiki obstajajo samo enojne vezi.
Splošna formula za alkan je CštH2št + 2 (n = poljubno celo število).
alken
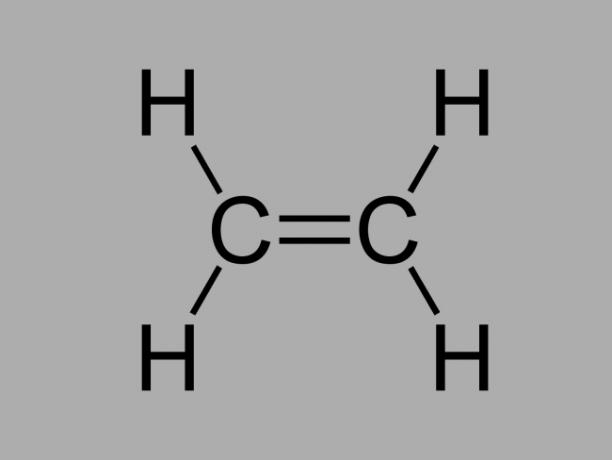
Imenuje se tudi olefin, alken ali etilen ogljikovodik, alken je slabo reaktivna spojina, kjer obstaja dvojna vez med ogljiki.
Splošna formula za alken je CštH2št.
alkin
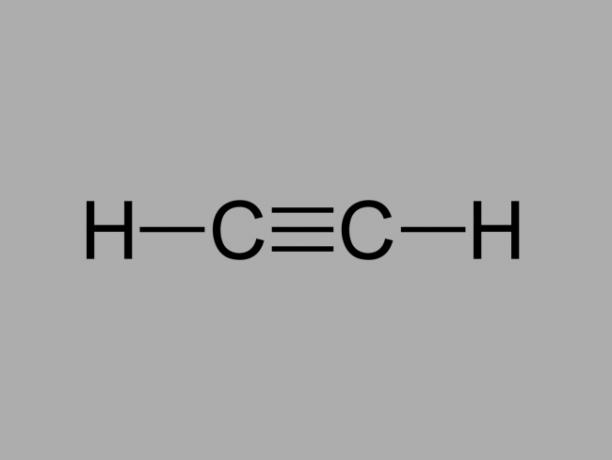
Imenuje se tudi metilacetilen, alkin je ogljikovodik, kjer so obstoječe vezi med ogljiki trojne.
Splošna formula za alkin je CštH2št-2.
alkadiene

Alkadieni, imenovani tudi dieni ali diolefini, so ogljikovodiki, pri katerih so vezi med ogljiki dvojne.
Splošna formula za alkadien je CštH2št-2.
Ciklični ogljikovodiki
Ciklični ogljikovodiki nastajajo v zaprtih ali cikličnih ogljikovih verigah. Te verige nimajo končnih ogljikov.
Primeri:
Cyclan
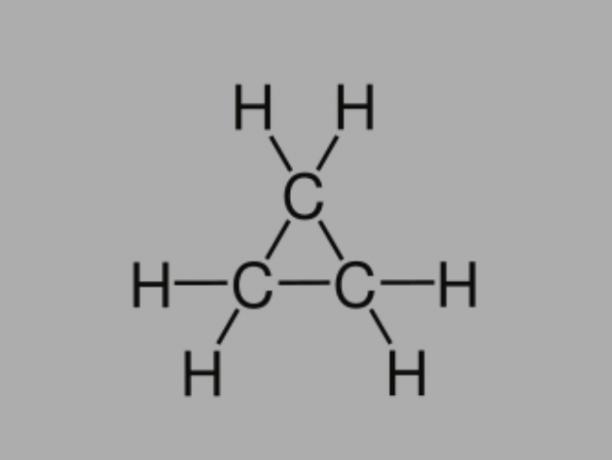
Imenuje se tudi cikloalkan, cikloparafin ali naftenski ogljikovodikciklan je nasičen ogljikovodik, sestavljen iz enojnih vezi.
Ima zaprto ogljikovo verigo in njegova splošna formula je CštH2št.
Ciklonsko

Imenuje se tudi cikloalkeni, cikli so nenasičeni ogljikovodiki, sestavljeni iz dvojnih vezi.
Ciklen ima zaprto ogljikovo verigo in njegova splošna formula je CštH2št−2.
kolesar
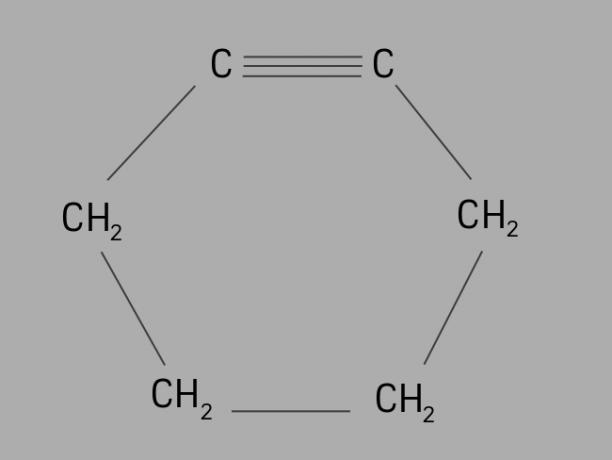
Imenuje se tudi cikloalkin ali cikloalkin, ciklin je ciklični in nenasičen ogljikovodik.
Tvori ga zaprta ogljikova veriga s trojnimi vezmi in njena splošna formula je CštH2št-4.
Aromatičen

ali

Imenuje se tudi arenah, aromatski ogljikovodiki so nenasičene spojine, ki nastanejo z dvojnimi vezmi.
Aromat ima zaprto ali ciklično ogljikovo verigo in njegova splošna formula je C6H6.
Vrsta vezave ogljikovih verig
Glede na vrsto povezave ogljikovih verig lahko ogljikovodike razvrstimo v nasičena ali nenasičen.
Spodaj glejte, iz česa je sestavljena vsaka od teh klasifikacij.
Nasičeni ogljikovodiki
Nasičene ogljikovodike tvorijo preproste povezave.
Primeri: alkani, ciklani.
nenasičeni ogljikovodiki
Nenasičene ogljikovodike tvorijo dvojne vezi ali trojke.
Primeri: alkeni, alkini, alkadieni.
Prisotnost alkilnih radikalov
Glede na prisotnost alkilnih radikalov imajo lahko ogljikovodiki ogljikovo verigo normalno ali razvejano.
normalna ogljikova veriga
Običajni ogljikovodik iz ogljikove verige nima alkilnih radikalov.
Primer: pentan
razvejana ogljikova veriga
Kadar ima ogljikovodik razvejano ogljikovo verigo, to pomeni, da ima glavna ogljikova veriga alkilne radikale.
Primer: metilpropan
Prisotnost heteroatomov, ki delijo ogljikovo verigo
Zaporedna ogljikova veriga se lahko razdeli ali ne, odvisno od prisotnosti heteroatomov.
Homogena ogljikova veriga
Kadar ima ogljikovodik homogeno glavno ogljikovo verigo, to pomeni, da je ta veriga ni razdeljen s heteroatomi.
Heterogena ogljikova veriga
Če ima ogljikovodik heterogeno glavno ogljikovo verigo, je ta veriga imela svoje razcepljena ogljikova veriga s heteroatomom.
Nomenklatura ogljikovodikov
Nomenklatura ogljikovodikov je opredeljena s kombinacijo treh delov:

Predpona določa količino ogljika, vmesna označuje vrsto vezi, pripona pa označuje funkcijo, ki ji spojina pripada (v tem primeru razred ogljikovodikov).
Spodaj si oglejte seznam predpon in vmesnih proizvodov, ki so kombinirani za označevanje ogljikovodikov.
Seznam predpon
| Število ogljikov | Predpona |
|---|---|
| 1 | Srečal- |
| 2 | Et- |
| 3 | Prop- |
| 4 | Ampak- |
| 5 | pent- |
| 6 | Hex- |
| 7 | Hept- |
| 8 | Okt- |
| 9 | Ne- |
| 10 | Dec- |
Seznam posrednikov
| Vrsta povezave | Posrednik |
|---|---|
| Samo en klic | -an- |
| Seznani | -en- |
| trojna | -in- |
| dva para | -dien- |
Oglejte si nekaj primerov poimenovanja ogljikovodikov.
Primeri:
CH3 - CH2 - CH2 - CH3
V zgornji strukturni obliki lahko vidimo 4-ogljikovo spojino, ki ima samo enojne vezi (označena s simbolom "-").
- Predpona za 4 ogljike = vendar-
- Vmesni izdelek za enojno vezavo = -an-
- Pripona ogljikovodika = -o
Glej, da je zveza predpona + vmesna + pripona poraja ime BUTAN.
CH2 = CH2
Zgornja strukturna oblika ima 2 ogljika in 1 dvojno vez (označena s simbolom "=").
- Predpona za 2 ogljika = et-
- Vmesni izdelek za dvojne obveznice = -en-
- Pripona ogljikovodika = -o
Glej, da je zveza predpona + vmesna + pripona poraja ime ETHENE.
CH2 = CH - CH2 - CH3
CH3 - CH = CH2 - CH3
Upoštevajte, da imata obe zgornji strukturni obliki 4 ogljikove in 1 dvojno vez (označena s simbolom "=").
Tako imamo:
- Predpona za 4 ogljike = vendar-
- Vmesni izdelek za dvojne obveznice = -en-
- Pripona ogljikovodika = -o
Glej, da je zveza predpona + vmesna + pripona bi povzročilo ime BUTEN za dve strukturni obliki.
Vendar upoštevajte, da strukturne oblike niso enake, zato nomenklature ne morejo biti enake.
Razlika med obema strukturnima oblikama je v lokaciji dvojne vezi.
V tem primeru moramo ogljike v verigi oštevilčiti od konca, najbližjega dvojniku. Zato moramo v zadevnih primerih oštevilčiti od leve proti desni.
V CH2 = CH - CH2 - CH3:
- CH2 bo enak 1
- CH bo 2
- CH2 bo 3
- CH3 bo 4
Upoštevajte, da dvojna vez je med ogljik 1 to je ogljik 2.
Za iskanje dvojne vezi moramo uporabiti najmanjše število (1): BUTEN -1
V CH3 - CH = CH2 - CH3:
- CH3 bo enak 1
- CH bo 2
- CH2 bo 3
- CH3 bo 4
Upoštevajte, da je dvojna vez med ogljik 2 to je ogljik 3.
Za iskanje dvojne vezi moramo uporabiti najmanjše število (2): BUTEN -2
Po navedbah IUPAC (Mednarodna zveza čiste in uporabne kemije - Mednarodna zveza za čisto in uporabno kemijo), kraj mora biti naveden nekoliko pred (v primeru zgornjih strukturnih oblik dvojna vez, predstavljena z vmesno "-En-").
S tem imamo drugi način, ki je mimogrede najbolj pravilen, pisanje nomenklature razpoložljivih strukturnih oblik.
CH2 = CH - CH2 - CH3: BUTENE -1 ali BUT-1-ENO (pravilnejša oblika)
CH3 - CH = CH2 - CH3: BUTENE -2 ali BUT-2-ENE (pravilnejša oblika)
Več o IUPAC in nomenklatura.


