Ti Ogljikovodiki so sestavljeni iz ogljik (C) in vodik (H). Prilagodljivost ogljika, ki je glavni element teh spojin, daje prednost obstoju velike raznolikosti struktur Zato se lahko nekatere lastnosti, kot sta tališče in vrelišče, med različnimi ogljikovodiki razlikujejo.
Večinoma so molekule apolar, s močs intermolekularno inducirani dipolni tip in gostota manjša od The iz vode. Identifikacija teh spojin je možna po nomenklaturi, ki sledi pravilom Mednarodne zveze za čisto in uporabno kemijo (Iupac).
Preberite tudi: Ogljik - eden najbolj razširjenih elementov v vesolju
Lastnosti ogljikovodikov

Polarnost: ogljikovodiki brez prisotnosti heteroatomov so apolar.
Medmolekularne sile: vezi med molekulami ogljikovodika so take vrste inducirani dipol.
tališče in inVreti: razlikujejo se glede na velikost, funkcijo in strukturno organizacijo molekule.
fizično stanje: v normalnih pogojih temperature in tlaka so ogljikovodiki s štirimi ali manj atomi ogljika v plinastem stanju. Tisti z 5 do 17 ogljiki so v tekočem stanju, ogljikovodiki z več kot 17 ogljiki pa so trdne snovi.
Gostota: je manjša od gostoto vode, tj. manj kot 1,0 g / cm3.
Reaktivnost: alifatski in nenasičeni ogljikovodiki so slabo reaktivni; nenasičene spojine pogosteje reagirajo z drugimi molekulami, ciklični ogljikovodiki z do petimi ogljiki pa so zelo reaktivni.
Ne ustavi se zdaj... Po oglaševanju je še več;)
Razvrstitev ogljikovodikov
Ogljikovodiki lahko razvrsti po strukturni organizaciji verige in s strani obratov.Nenasičenost je prisotnost dvojne (-ih) ali trojne vezi med ogljiki, je pojav priključki tipa pi (π). že veje so kot "veje", pritrjene na večjo strukturo ogljikovodikov. Ciklične verige lahko vsebujejo tudi veje in / ali nenasičenosti - strukturna organizacija zaprtih verig ogljikovodikov tvori med drugim mnogokotnike, kot so kvadrat, trikotnik, heksan.
Kar zadeva razporeditev atomov, ima lahko ogljikovodik normalno ali razvejeno verigo.
→ C ogljikovodiknormalna, linearna ali ravna črta: tisti z vrvico, ki ima samo dva konca.

→ C ogljikovodiksovraži razvejano: tisti z verigo, ki ima več kot dva konca. Da bi vedeli, kje in kakšne so veje, je pomembno pravilno izbrati glavno verigo. Glavna veriga mora vsebovati vse nenasičene snovi in heteroatome (če obstajajo), tako dobro, kot največje število zaporednih ogljikov. Ogljiki, ki jih ne vsebuje glavna veriga, so veje.
Primer:

Glede na "zaprtje" ima lahko ogljikovodik zaprto, odprto ali mešano verigo.
→ Verižni ogljikovodikis zaprto ali ciklično: tiste z verigami, v katerih se atomi organizirajo, da tvorijo cikel, poligon ali aromatski obroč (zaprt ogljikovodik z izmeničnimi nenasičenostmi) Ne imejte ohlapnih koncev, če ni veje. Vsaka točka poligona predstavlja ogljik in njegova vodikova veziva.
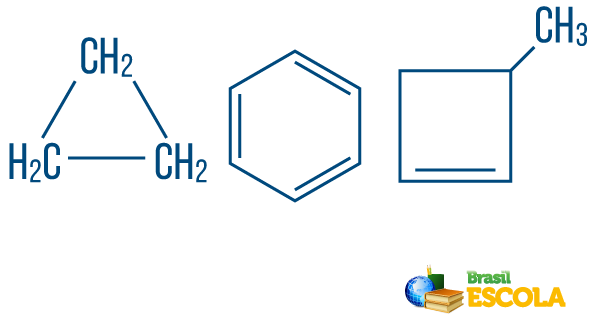
→ Odprte verige ali aciklični ogljikovodiki: so tiste z verigami, ki imajo vsaj dva konca.

→ Ogljikovodik iz niz mešanega tipa: je tvorjena z obročem ali ciklično verigo, pritrjeno na linearni del; ima vsaj en konec.
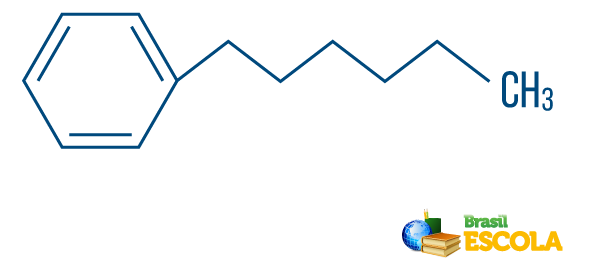
Preberite tudi: Aromatski ogljikovodiki - primeri in lastnosti
Nomenklatura ogljikovodikov
Za vsako vrsto ogljikovodika obstaja pravilo poimenovanja, ki ga je vzpostavil Iupac. Nomenklatura teh spojin je narejena na naslednji način:
1. del: kraj in ime podružnice (če obstaja);
2. del: izraz velja cikel če je spojina zaprta veriga, če pa je alifatska (odprta) veriga, ne bo potrebna;
3. del: predpona, ki označuje, koliko ogljika je v glavni verigi;
4. del: lokacija in infiks, ki označujeta vrsto nenasičenosti v molekuli;
5. del: končnica "o" lastna ogljikovodikom.
Če ima molekula odprto strukturo, brez razvejanja, se bo nomenklatura začela v 3. delu.
Naslednja tabela prikazuje zahtevane informacije (predpono, pripono in pripono) za ogljikovodikovo nomenklaturo na splošno. O predpono se spreminja s številom ogljikov; O infix, glede na število nezasičenosti; to je končnico“O " se nanaša na spojine ogljikovodikovega tipa.
Predpona |
Infix |
Pripona |
||
1 ogljik |
srečal- |
Samo enojni klici |
-an- |
-O |
2 ogljika |
et- |
|||
3 ogljiki |
podpora |
1 dvojna vez |
-en- |
|
4 ogljiki |
ampak- |
|||
5 ogljikov |
pent- |
2 dvojni vezi |
-dien- |
|
6 ogljikov |
šestnajstik |
|||
7 ogljikov |
hept- |
1 trojna vez |
-in- |
|
8 ogljikov |
okt- |
|||
9 ogljikov |
ne- |
2 trojni povezavi |
-diin- |
|
10 ogljikov |
dec- |
Prvi korak pri odkrivanju nomenklature organske spojine je identificirati glavno verigo ogljikov, ki morajo vsebovati nenasičene snovi in čim več zaporednih ogljikovih atomov. Po identifikaciji glavne verige, ogljike je treba našteti - začetek štetja s strani, ki je najbližja vejam, in nenasičenosti (če obstajajo). THE lokalizacija bo število ogljika, kjer je ugotovljena veja ali nenasičenost. Včasih obstaja le ena možna lokacija radikalne ali dvojne ali trojne vezi, zato v nomenklaturi ni treba izraziti lokacije veznega ogljika.

THE nomenklatura za podružnice bo podano s številom ogljikov v vsaki, plus zaključek črta ali ll. Če je vej več, se uporablja abecedni vrstni red.
Oglejte si naslednje primere:
→ Primer 1
CH3 - CH2 - CH3 → Propan
1. del: predpona „podpora"Pomeni, da ima veriga tri ogljike.
2. del: infix "-an-”Signalizira, da molekula vzpostavlja le takšne povezave sigma ali preprosto.
3. del: pripona "-O"Je značilno za ogljikovodike.
→ 2. primer
CH2= CH-CH2-CH3 → Ampak-1-en
Pri ogljikovodikih z nenasičenostjo je treba oštevilčiti in locirati ogljik, v katerem se nahaja par, in oštevilčenje mora biti čim manjše. Za to se mora število ogljika začeti s strani, ki je najbližja dvojni vezi.
1. del: "ampak- " pomeni, da so v verigi štirje ogljiki.
2. del: "1-sl" se nanaša na nenasičenost, ki se nahaja med ogljikom 1 in 2.
3. del: "-O" je značilna pripona ogljikovodikov.
→ 3. primer

1. del: "3-etil" signalizira, da na ogljiku 2 obstaja veja z dvema ogljikoma.
2. del: "-pent-" označuje prisotnost petih ogljikov v glavni verigi.
3. del: "-an-" je vezava, ki se uporablja za nenasičene verige (brez dvojnih ali trojnih vezi).
4. del: "-O" je značilna pripona ogljikovodikov.
→ 4. primer
Za verige z več kot eno vejo, postavite radikale v nomenklaturo po abecedi. Če so v isti molekuli veje in nenasičenosti, je treba število ogljika v glavni verigi opraviti tako, da je vsota lokacijskih številk čim manjša.
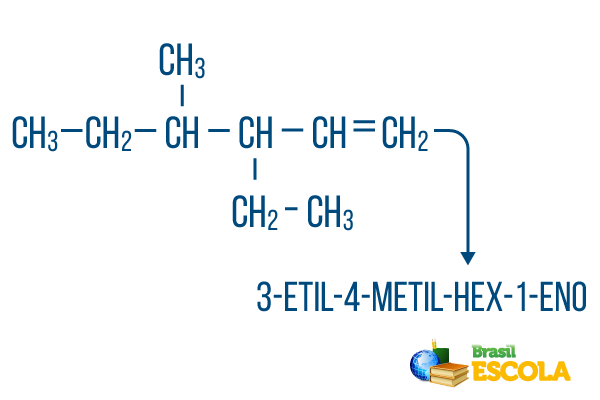
Število ogljika v glavni verigi je bilo opravljeno od leve proti desni, vsota številk nenasičenosti in lokacije vej pa je: 1 + 4 + 3 = 8. Če bi bilo število ogljika od desne proti levi, bi bila sestavljena nomenklatura 4-etil-3-metil-5-en, katerega vsota lokacij bi bila: 4 + 3 + 5 = 12, kar je večje od druge hipoteze, zato je ne bi smeli uporabljati.
1. del: 3-etil-4-metil se sklicuje na radikale po abecedi in na njihovih lokacijah.
2. del: šestnajstik pomeni, da je v glavni verigi 6 ogljikov.
3. del: 1-sl označuje prisotnost dvojne vezi na ogljiku 1.
4. del: "-O" je značilna pripona ogljikovodikov.
→ Primer 5
Za zaprte nize veljajo pravila poimenovanja, vendar beseda cikel začne ime spojine, kar pomeni, da gre za zaprt ali cikličen ogljikovodik.
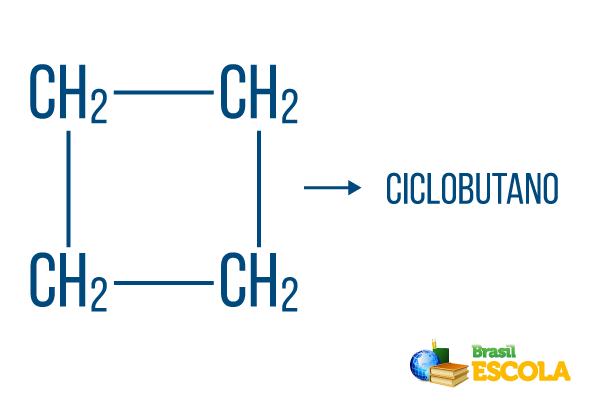
1. del: kolesarjenje označuje, da gre za zaprti niz.
2. del: -ali- označuje obstoj 4 ogljikov v verigi
3. del: -Oje značilna pripona ogljikovodikov.
Preberite tudi: Klasifikacija ogljikovih verig
Vrste ogljikovodikov
Ogljikovodike lahko razdelimo na alkane, alkene, alkine in alkadiene - ki so razvrščeni kot glede na vzpostavitev verige (dvojne ali trojne vezi) - in ciklani, ki so verige zaprto.
→ Alkani: so ogljikovodiki, ki niso nenasičeni. Splošna formula za alkane je CštH2n + 2, in štznamenje sestavljajo ga predpono + an + O.
Ti alkani lahko najdemo v naravikot plin metan (CH4), ki ga živali sprostijo in proizvedejo v postopkih razgradnje ter v rafinerijah in petrokemični industriji. Spojine kot propan (Ç3H7), butan (Ç4H10), ki tvori naš kuhalni plin (LPG), in oktan (Ç8H18), ki so prisotni v avtomobilskem gorivu, so stranski proizvodi Nafta.

→ alkeni ali alkeni: so ogljikove verige, ki imajo nenasičenost, dvojno vez. Njegova splošna formula je CštH2n, in tvoj štznamenje sestavljajo ga Ppopraviti + en + o.

O etilen plin (Ç2H4), ki se v kmetijstvu uporablja za pospeševanje zorenja plodov, spada v to funkcijo alken. Spojina se uporablja tudi pri proizvodnji surovin polietilen, ki se uporabljajo pri izdelavi posode iz plastike.
→ Alkini ali acetilenski: ogljikovodiki s trojno vezjo. Njegova splošna formula je CštH2n - 2. THE nomenklatura sestavljajo ga predpona + v + o.

O acetilen ali etin (C2H2) je plin alkinske funkcije, uporabljen v zvari in kovinski kosi. Ta spojina lahko doseže temperature do 3000 ° C, kar omogoča popravila na potopljenih delih ladje.

→ alkadiene ali diene: ogljikove verige z dvema nenasičenoma, to sta dve dvojni vezi med ogljiki. Splošna formula za to funkcijo je C.štH2n - 2. Zavedajte se, da gre za enako formulo kot alkini, kar pomeni, da se lahko zgodi izomerija med spojinami (enaka molekulska formula za različne spojine).
Nomenklaturo alkadiene sestavljajo Ppopraviti + dien + o.
Primer:

→ Ogljikovodiki v zaprti verigi: molekule se organizirajo ciklično, ponavadi tvorijo poligon in tako kot v odprtih verigah lahko obstajajo ustanove in / ali posledice. Cikloni, cikli, ciklini in benzeni so zaprti verižni ogljikovodiki.
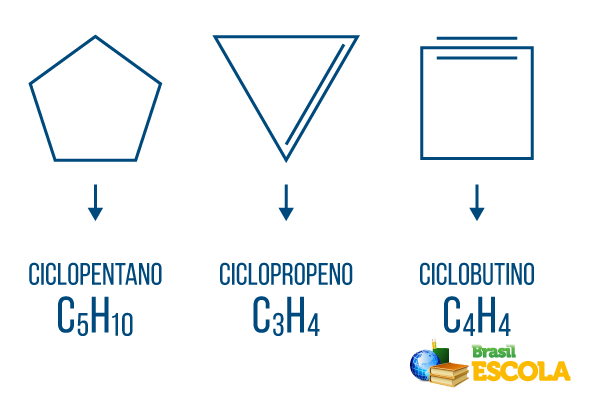
Cikloni ali cikloalkani: ciklične verige, sestavljene samo iz enojnih vezi. Njegova splošna formula je CštH2n. Nomenklatura: ciclo + predpona + an + o.
Cikli ali cikloalkeni: zaprte verige ogljikovodikov z obratom. Njegova splošna formula je CštH2n-2. Nomenklatura: çiclo + predpona + sl + O.
-
Ciklini ali cikloalkini: zaprti verigi ogljikovodikov s prisotnostjo dveh dvojnih vezi. Njegova splošna formula je CštH2n-4. Nomenklatura: çiclo + predpona + v + o.
benzeni
Benzen je vrsta ogljikovodika z zaprto verigo z šest ogljikov kjer se obveznice razlikujejo med enojnimi in dvojnimi. Te spojine so strupen in zelo rakotvoren, uporablja se kot organska topila v kemičnih procesih.
Da bi ogljikovodik lahko štel za aromatičnega, mora biti vsaj en benzenski obroč, ki je zelo reaktiven, zato je predmet dveh ali več zamenjave, kar bomo tukaj videli kot posledice. Ko obstajata dva povezovalna radikala, bomo imeli posebna imena za vsak par položajev.
Radiali na 1,2 ogljiku benzena → orto
Radikali na 1,3 ogljika benzena → cilj
Radiali na ogljiku 1,4 benzena → za
Annomenklatura aromatske spojine se izvede na naslednji način:
1. del: pozicioniranje ligandov (orto, cilj ali).
2. del: ime radikala ali radikalov, vezanih na benzen (metil, etil, propil…). Ime radikalov sledi pravilu drugih ogljikovodikov.
- 3. del: -Bstrup, kar je značilen izraz za aromatske ogljikovodike.
Primeri:
→ Orto-dimetil-benzen

1. del: Orto- označuje, da so radikali nameščeni na ogljikih 1 in 2.
2. del: -dimetil- se nanaša na dva radikala, oba z enim ogljikom.
3. del: -benzen je značilen izraz za aromatske ogljikovodike.
→ Orto-etil-metil-benzen
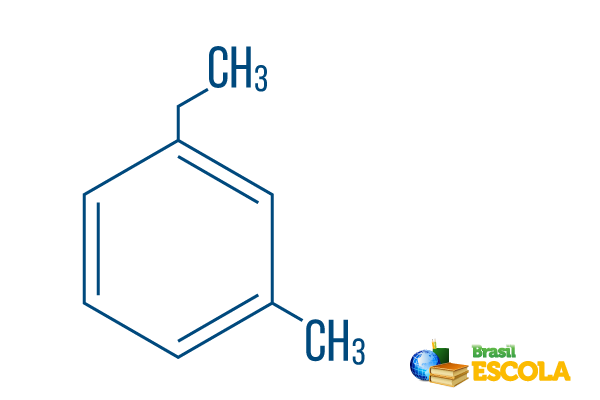
1. del: moh- označuje, da so radikali nameščeni na ogljikih 1 in 3.
2. del: etil-metil- se nanaša na količino ogljika v vsakem radikalu, ki je etil The dvoogljična veja in metil razvejanje z enim ogljikom - v nomenklaturo uvrščeno po abecedi.
3. del: -benzen je značilen izraz za aromatske ogljikovodike.
→ para-dietil-benzen
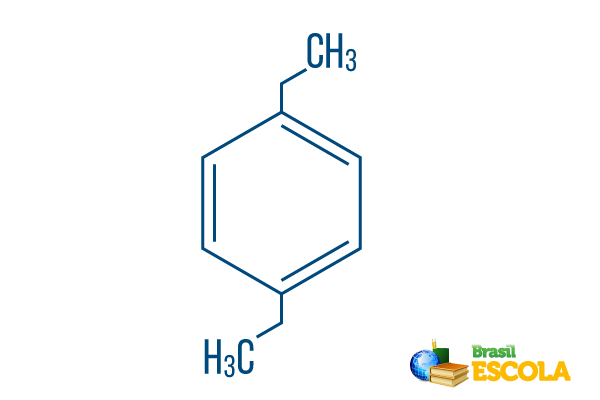
1. del: Pplug kaže, da so radikali na ogljikih 1 in 4 benzena.
2. del: -dietil- se sklicuje na dva radikala te vrste etil, to je dve veji s po dvema ogljikoma.
3. del: -benzen je značilen izraz za aromatske ogljikovodike.
Preberite tudi:Odkritje strukture benzena
rešene vaje
(Unesp) - Oktan je ena glavnih sestavin bencina, ki je mešanica ogljikovodikov. Molekulska formula oktana je:
a) C8H18
b) C8H16
c) C8H14
d) C12H24
e) C18H38
Odgovor: črka a). Analiza sestavljene nomenklature oktan, gre za alkan, to je molekulo, sestavljeno samo iz enojnih vezi. Če je splošna formula za alkane CštH2n + 2, nadomestimo "n" z osem, kar je količina ogljika v glavni verigi - in v tem primeru edinstvena -, imeli bomo, da je molekulska formula oktana C8H18.
(UFSCar-SP) - Upoštevajte naslednje trditve o ogljikovodikih.
I) Ogljikovodiki so organske spojine, sestavljene samo iz ogljika in vodika.
II) Samo nenasičeni ogljikovodiki z ravno verigo se imenujejo alkeni.
III) Cikloalkani so nasičeni alifatski ogljikovodiki s splošno formulo CnH2n.
IV) Ali so aromatski ogljikovodiki: bromobenzen, p-nitrotoluen in naftalen.
Naslednje trditve so pravilne:
a) samo I in III.
b) samo I, III in IV.
c) samo II in III.
d) samo III in IV.
e) samo I, II in IV.
Odgovor: Črka a).
II - Alkeni so spojine z dvojno vezjo, torej nenasičene, vendar imajo lahko v svoji verigi posledice, ki niso izključno linearne.
IV - Brometobenzen in p-nitrotoluenske spojine spadajo med druge organske funkcije.
avtor Laysa Bernardes
Učitelj kemije