“Kemična vez «je bil izraz, ki ga je Gilbert Newton Lewis prvič uporabil leta 1920 v članku, da bi razložil, zakaj da se atomi držijo skupaj in tvorijo snovi in tudi zakaj se držijo skupaj na tisoče stara leta.
Atomi večine kemičnih elementov, ki so bili doslej znani in našteti v periodnem sistemu, se v naravi ne pojavljajo v izolirani obliki. Večina materialov, ki so prisotni v našem vsakdanjem življenju, je snovi, ki so lahko preproste (sestavljene iz atomov samo ene vrste kemičnega elementa) ali kompoziti (imajo atome dveh ali več kemičnih elementov veliko različnih).
To je zato, ker imajo atomi sposobnost, da tvorijo kemične vezi z drugimi atomi, ki so lahko isti ali različni elementi. Te vezi so tako močne, da bodo brez kakršnega koli zunanjega vpliva atomi v večini primerov ostali povezani, kakršni so.
Zemljevid uma: Kemične vezi

* Če želite prenesti miselni zemljevid v PDF, Klikni tukaj!
Na primer, v naravi ni običajno najti prostega atoma kisika; najdemo pa več snovi, v katerih se zdi, da je pritrjena na druge atome. Primer preproste snovi je kisikov plin, v katerem vsako molekulo tvorita dva vezana atoma kisika (O
2); medtem ko je primer sestavljene snovi voda, kjer ima vsaka molekula dva atoma vodika, vezana na atom kisika (H2O).Edini elementi, ki so stabilno izolirani v naravi, so žlahtni plini, to so elementi družine 18 periodnega sistema (He, Ne, Ar, Kr, Xe in Rn). Vsem tem elementom je skupno dejstvo, da imajo v zadnji elektronski lupini (valentna plast) osem elektronov, z izjemo helija (He), ki ima samo eno elektronsko lupino (K plast) in ima zato dva elektrona, kar je največje možno število elektronov v tej plast.
Tako je Gilbert N. Lewis in tudi znanstvenik Water Kossel sta prišla do zaključka, da atomi ostalih elementov se vežejo na osem elektronov (ali dva, če imate samo K lupino) in se tako stabilizirajo. Nastal je torej elektronska teorija valence, ki kaže, koliko kemičnih vezi tvori atom elementa na podlagi razložene ideje.
Ne ustavi se zdaj... Po oglaševanju je še več;)
Zato atomi tvorijo kemične vezi in skušajo izgubiti, pridobiti ali deliti elektrone valentne lupine, dokler ne dosežejo konfiguracije naslednjega žlahtnega plina.Tudi ta teorija se je začela imenovati pravilo okteta.
Na primer, kisik je dvovalenten, ker ima v svoji valentni lupini šest elektronov. Zato mora sprejeti še dva elektrona, da imata konfiguracijo neona plemenitega plina (Ne), to je z osmimi elektroni v valentni lupini, ki je v tem primeru L lupina. V primeru omenjenih kisikovih plinov in vode imamo naslednje:
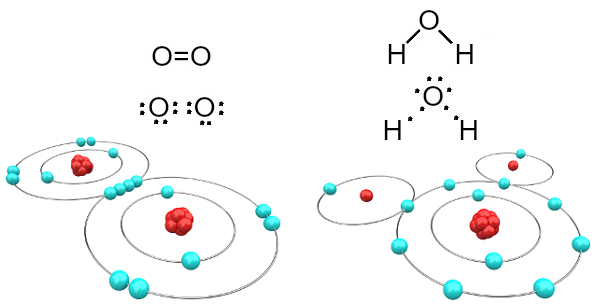
Molekule kisika in vode, tvorjene s kovalentnimi vezmi
Upoštevajte, da je v prvem primeru (kisik plin - O2), ima vsak atom kisika dva elektrona, ki imata osem elektronov v valentni lupini. To pomeni, da a dvojna vez (dve vezi hkrati med dvema atomoma).
V primeru vode si vsak od dveh atomov vodika deli elektron z osrednjim atomom kisika in vsi so stabilni (kisik ima osem elektronov v valentni lupini, vsak vodik pa dva elektroni). Tu sta tudi dve preprosti povezavi.
Ta vrsta kemične vezi, v kateri morajo vsi atomi sprejeti elektrone (vodik, nekovine in poldmetal) in v kateri se elektroni delijo v parih, se imenuje kovalentna vez.
Obstajata pa še dve vrsti kemičnih vezi:
(1) ionska vez → obstaja dokončen prenos elektronov z enega atoma na drugega. Ta vrsta vezi se pojavi med kovinskimi atomi (ki ponavadi izgubijo elektrone, da ostanejo stabilni) in atomi vodika, nekovine in polkovine (ki nagibajo k pridobivanju elektronov, da ostanejo stabilno).
Primer je natrijev klorid (NaCl - kuhinjska sol), kjer je natrij kovina, ki ima tendenco izgube elektrona, medtem ko je klor nekovina, ki teži k pridobivanju elektrona. Tako natrij donira(rdeča puščica)elektron do klora, tvori sol, zelo stabilno snov. Ker diplomirajo (črna puščica) ioni, ki so kemične vrste z nasprotnimi naboji (+ in -), en ion privlači drugega v bližini in ionski grozdi nastanejo z ogromnim številom ionov, prav tako kristali v kuhinjski soli.

Tvorba natrijevega klorida z ionsko vezjo
(2) Kovinska povezava → Teorija je, da kovine (kot so aluminij, zlato, srebro, baker itd.) Tvorijo grozdi nevtronskih atomov in kationov, ki jih drži nekakšen "oblak" prostih elektronov (elektroni, ki so se izgubili pri tvorbi kationov navedena). Ta oblak (ali morje) elektronov bi deloval kot kovinska vez, ki bi držala atome skupaj.
Za več podrobnosti o teh vrstah kemičnih vezi in o pravilu okteta preberite spodnje članke.
Zemljevid uma M.e Victor Ricardo Ferrreira
Učitelj kemije
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Kemija

Jonska vez, dogovori med ionskimi spojinami, ionskimi aglomerati, natrijevim kloridom, kuhinjsko soljo, ionsko snovjo, elektrostatične privlačne sile, kloridni anioni, natrijevi kationi, polarna topila, pozitivni ioni, kationi, negativni ioni, anioni.