Ob organske reakcije izločanja so tisti, pri katerih se atomi ali skupine atomov molekule odstranijo ali izločijo iz nje, ustvarjanje nove organske spojine, poleg anorganske spojine, ki jo tvori del, ki je bil črtano.
Ena vrsta reakcije izločanja je dehidracija, v kateri je izgubljena molekula voda. Dehidracija alkoholov (spojin, ki imajo OH skupino, povezano z nasičenim ogljikom v odprti verigi) lahko poteka na dva načina: intramolekularno in medmolekularno.
"Intra" pomeni "znotraj", zato do intramolekularne dehidracije alkoholov pride, ko molekula vode izstopi iz "notranjosti" same molekule alkohola. V tem primeru bo nastali organski proizvod alken.
Ta reakcija poteka le v prisotnosti katalizatorja, ki deluje kot sušilo, in največkrat gre za koncentrirano žveplovo kislino (H2SAMO4) in temperatura naj bo okoli 170 ° C.
Primer:
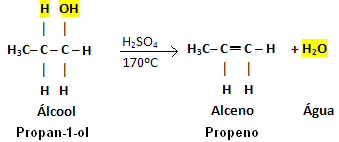
Upoštevajte, da je skupina OH zapustila, vodik pa sosednji ogljik in povzročil vodo. Poleg tega je nastala dvojna vez, ki je povzročila alken.
Objekt za dehidracijo sledi naslednjemu padajočemu vrstnemu redu:
Terciarni alkoholi> Sekundarni alkoholi> Primarni alkoholi
Kaj pa, ko skupina OH pride na sredino ogljikove verige? Atom vodika, iz katerega bo sproščen sosednji atom ogljika in tvori molekulo vode?
Ne ustavi se zdaj... Po oglaševanju je še več;)
Na primer, naslednji je 2-metilpentan-3-ol. Upoštevajte, da je en sosednji atom ogljika terciarni (označen z rdečo), drugi pa sekundarni (označen z modro):
H OH H
│ │ │
H3C─ Ç ─ Ç ─ Ç CH3
│ │ │
H H CH3
Vodik, vezan na terciarni atom ogljika, bo lažje zapustiti, ker je njegov elektronegativni značaj enak δ+1Torej, manj kot bo negativni značaj ogljika, šibkejša bo vez med njimi in lažje bo pretrgala njihovo vez.
V takih primerih nastanejo vse možne spojine, vendar bo prevladovanje podano v vrstnem redu: Terciarni alkoholi> Sekundarni alkoholi> Primarni alkoholi.
Torej imamo:
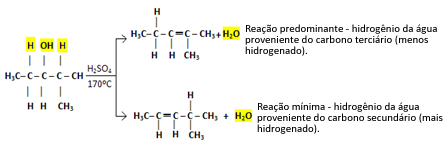
Ta vrsta reakcije uboga Saytzefovo pravilo, kar pravi, da večja bo težnja vodika, da bo ogljik manj hidrogeniran. To pravilo je ravno nasprotno od Markovnikovo pravilo uporablja za adicijske reakcije.
Če želite dopolniti svoje znanje o tej temi, preberite tudi besedilo "Medmolekularna dehidracija alkoholov”.
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
FOGAÇA, Jennifer Rocha Vargas. "Intramolekularna dehidracija alkoholov"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/desidratacao-intramolecular-dos-Alcoois.htm. Dostopno 28. junija 2021.