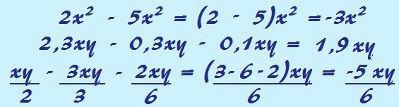Ogljik je kemični element z atomskim številom (Z), ki je enako 6, kar pomeni, da imajo atomi, ki ga tvorijo, v svojem jedru šest protonov. Njegova molska masa je 12.011 g / mol in v naravi najdemo tri izotope ogljika, ki so: o ogljik-12, ogljik-13 in ogljik-14. C-12 ima v jedru šest protonov in šest nevtronov in je največ.
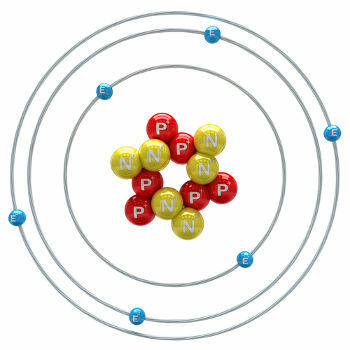
ilustracija ogljikovega atoma-12
C-13 ima sedem nevtronov in je najmanj (1,01 do 1,14%). C-14 ima osem nevtronov in je a radioaktivni element ki oddaja delce β (elektrone), ki nastanejo v stratosferi Zemlje, ko nevtroni vesoljskih žarkov bombardirajo dušik-14, ki je prisoten v teh zgornjih plasteh ozračja. Vključijo ga vse rastline in živali in se ob vedenju, da je njegov razpolovni čas približno 5730 let, uporablja za določanje starosti fosilov med 100 in 40.000 leti. Več podrobnosti o C-14 in tehniki zmenkov je razvidno iz besedila. Kaj je ogljik-14?
Ogljik je četverovalenten, torej potrebuje še štiri protone v svoji valentni plasti (najbolj zunanji sloj), da bi spoštoval pravilo okteta. Zato običajno tvori štiri kovalentne vezi, pri čemer deli štiri pare elektronov z drugimi elementi, pa tudi z drugimi ogljiki. Te vezi so lahko enojne, dvojne ali trojne in povzročijo nastanek milijonov različnih spojin. Iz tega razloga je bilo ustvarjeno področje kemije,
Organska kemija, ki preučuje glavne spojine, pridobljene iz ogljika, z izjemo nekaterih primerov, ki so mineralnega izvora, kot je npr ogljikov dioksid (CO2), O ogljikov monoksid (CO), O kalcijev karbonat (CaCO3), natrijev hidrogenkarbonat oz natrijev bikarbonat (NaHCO3), med drugimi. Te spojine preučujemo v Anorganska kemija.Ogljik izvaja alotropijo in tvori enostavne snovi, torej snovi, ki nastanejo samo z vezmi med atomi ogljika. Obstaja vsaj sedem alotropov ogljika, to so grafit (alfa in beta), diamant, lonsdaleit (šesterokotni diamant), kaoit, ogljik (VI) in fulereni. Dejansko obstaja več vrst fulerenov, ki so sintetične alotropne oblike ogljika. Imajo poliedrsko strukturo z atomom ogljika na vsaki točki in primer je Ç60 poklical buckminsterfullerene, njegova struktura pa je videti kot nogometna žoga.
Ne ustavi se zdaj... Po oglaševanju je še več;)
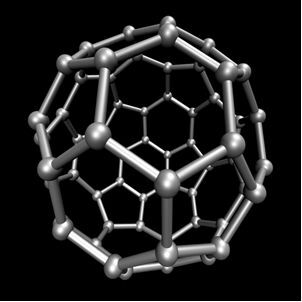
Ogljik-60 (buckminsterfullerene)
Vendar pa sta med temi alotropi ogljika le dva naravna. grafitJe od Diamant. Razlikujejo se le po kristalni razporeditvi atomov v vesolju, kot prikazuje spodnja slika, kar ima za posledico povsem različne fizikalno-kemijske lastnosti. Preberi besedilo alotropija ogljika za več informacij.

Dve naravni alotropni obliki ogljika sta grafit in diamant.
Druga sintetična alotropna oblika ogljika je nanocevke (slika spodaj), ki imajo široko biološko uporabo, vključno z medicinsko diagnostiko in zdravljenjem.

Prikaz mikroskopske ogljikove nanocevke
Tako ogljik je prisoten v vsem okoli nas in v nas, ker sestavlja naravne organske spojine - na primer fosilna goriva, ki med drugim vključujejo nafto, premog in zemeljski plin ter druga goriva, kot sta etanol in biogoriva - kmetijski proizvodi. tudi oblika sintetične organske spojine, kot so sintetična vlakna, ki tvorijo tkanine, zdravila, polimeri, ki tvorijo plastiko in gume, insekticidi, barvila in še veliko več. V nas, živalih in zelenjavi, ogljik tvori zelo pomembne spojine, kot so ogljikovi hidrati, kot so sladkor, glukoza in celuloza; beljakovine, ki tvorijo na primer DNK in skupaj z lipidi tvorijo membrane rdečih krvnih celic in belih krvnih celic.
Vse to kaže na pomen ogljika za ohranjanje življenja. Vendar je bilo povezano tudi z negativnimi vidiki, na primer z okrepitvijo Učinek tople grede in posledično globalno segrevanje, ker je glavni zlobnik teh težav njegova ogljikova dioksidna spojina (CO2). Predvsem zaradi velikega izgorevanja fosilnih goriv, ki sproščajo ta plin, koncentracija CO2 v ozračju se je povečalo. Kot toplogredni plin povzroča omenjene težave. Po drugi strani pa je ogljikov dioksid prisoten tudi v vitalnih reakcijah, kot sta fotosinteza in dihanje.
Avtorica Jennifer Fogaça
Diplomiral iz kemije