Ob medmolekularne sile so sile elektrostatičnega privlačenja, katerih naloga je združiti molekule (molekularne spojine) in jih ohraniti v trdnem ali tekočem stanju. Izjemno pomembni so, saj določajo vse fizikalne lastnosti (tališče, vrelišče, gostota in topnost) snovi.
V tem besedilu bomo preučevali razmerje med medmolekularnimi silami in vreliščem snovi. Sprva se spomnimo na tri pomembne vrste medmolekularnih sil, in sicer:
♦ dipol dipol: je sila, ki se pojavi v polarnih molekulah. Ker imajo te molekule pozitivni in negativni pol, dipol-dipolna sila temelji na privlačnosti med pozitivnim koncem ene molekule in negativnim koncem druge. Primeri: HCl, HBr, SO2 in PH3
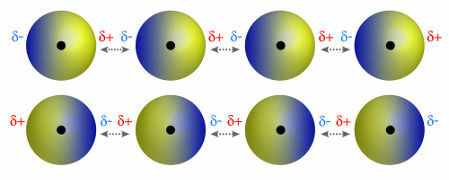
Molekule, ki imajo pozitivni in negativni pol, ki se privlačijo
♦ Inducirani dipol: je medmolekularna sila, ki se pojavi samo v nepolarnih molekulah (nimajo polov). Ko se približata dve apolarni molekuli, pride do trenutne deformacije njihovih oblakov elektronov, kar povzroči neravnovesje v elektronih molekule, ki so razporejeni v zanjo drugačen. Takrat nastane trenutni dipol in molekula ima za trenutek pozitivni in negativni pol, kar povzroči privlačnost. Primeri: CO
2, CH4 in BH3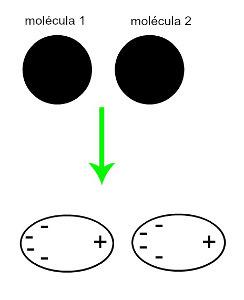
Približanje dveh nepolarnih molekul povzroči deformacijo in posledično prerazporeditev elektronov, ki tvori trenutne dipole
♦ Vodikove vezi: to je medmolekularna sila, ki se pojavlja v polarnih molekulah, vendar le pri tistih, ki imajo nujno atome vodika, vezane neposredno na atome fluora, kisika ali dušika. Lahko se šteje za dipol-dipolno silo, vendar veliko večje intenzivnosti. Interakcija vedno poteka med vodikom ene molekule in drugim atomom (F, O, N) druge molekule. Primeri: H2O, NH3 in HF
Ne ustavi se zdaj... Po oglaševanju je še več;)
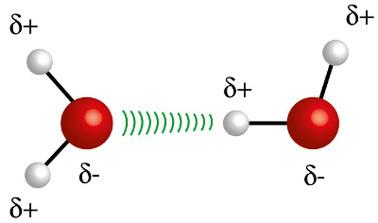
Atom vodika (bela krogla) ene molekule sodeluje s kisikom (rdeča krogla) druge molekule vode
Ko smo se spomnili treh medmolekularnih sil, jih lahko zdaj povežemo s vreliščem snovi. je poklican vrelišče temperatura, pri kateri molekule dane snovi prenehajo biti v tekočem stanju (imajo prekinjene medmolekularne sile) in preidejo v plinasto stanje. Zanimiva podrobnost je, da medmolekularne sile in vrelišče snovi imajo zelo intenziven in neposreden odnos, saj močnejša je medmolekularna sila, višje je vrelišče. Vrstni red intenzivnosti medmolekularnih sil je:
Inducirani dipol
Tako lahko sklepamo, da imajo molekule, ki imajo kot interakcijsko silo vodikove vezi, višje vrelišča kot tiste, ki imajo dipol-dipol itd. Spodnja tabela prikazuje tri snovi in njihove vrednosti vrelišča:
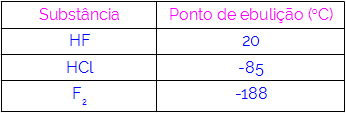
V tabeli opažamo, da ima HF višje vrelišče, saj se njegove molekule povezujejo z vodikovimi vezmi. Snov F2 ima najnižje vrelišče, saj njegove molekule privlači inducirani dipol.
Jaz, Diogo Lopes Dias
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
DNI, Diogo Lopes. "Medmolekularne sile in vrelišče snovi"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/forcas-intermoleculares-ponto-ebulicao-das-substancias.htm. Dostop 27. junija 2021.
Kemija
Molekulske snovi, temperatura vrelišča, kontaktna površina, vrelišče, medmolekularne privlačne sile, kemijske vezi, molekularne spojine, kovalentne kemijske vezi, ionske vezi, kovinske vezi, fizikalna stanja slab