O načelo Le Chatelierja nam pove, da ko se motnja povzroči v sistemu v ravnovesju, se bo premaknil v smer, ki zmanjša sile, ustvarjene s to motnjo, in vzpostavi novo kemijsko ravnovesje.
Ena od teh motenj je temperaturne razlike. Ta sprememba je pomembna, ker bo poleg tega, da bo povzročila premik ravnotežja, spremenila tudi vrednost ravnotežne konstante, Kç.
Da boste bolje razumeli, kako se to zgodi, si oglejmo primer:
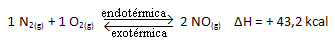
Kç = _[ PRI]2___
[N2]. [O2]
Zgornja reakcija poteka v neposredni smeri z absorpcijo energije, je endotermna. Po drugi strani pa se zgodi obratni proces s sproščanjem energije, ki je eksotermna reakcija.
Če torej povišamo temperaturo sistema, se bo kemijsko ravnovesje premaknilo proti endotermni reakciji, ki je v tej reakciji desno. To je tako, da se toplota absorbira in vzpostavi ravnotežje.
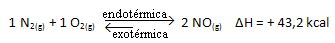
Res je tudi nasprotno; če znižamo temperaturo tega sistema, se bo reakcija premaknila v smer, da bo sproščal toploto, ker se bo celotna energija reakcije zmanjšala. To pomeni, da se bo ravnotežje premaknilo proti eksotermni reakciji, ki je v tem primeru levo:
Ne ustavi se zdaj... Po oglaševanju je še več;)
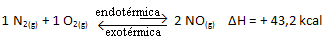
V kratkem:

Glede na ravnotežno konstanto (Kç), ko se temperatura poveča, je naklonjena endotermni reakciji in več NO(g) nastaja, povečuje njegovo koncentracijo in zmanjšuje koncentracijo reaktantov. V spodnji formuli upoštevajte, da je koncentracija NO(g) je sorazmerna s konstanto Kçzato se tudi poveča:
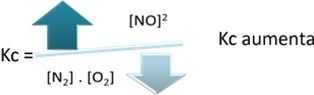
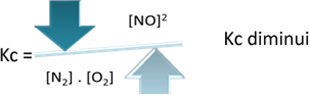
Če pa znižamo temperaturo in reakcijo premaknemo proti eksotermni reakciji, se koncentracija produkta NO zmanjša in koncentracije reaktantov se povečajo. Ker so koncentracije reaktantov obratno sorazmerne s konstanto Kc, se bo zmanjšala:
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
FOGAÇA, Jennifer Rocha Vargas. "Temperaturne variacije in premik kemičnega ravnovesja"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/variacao-temperatura-deslocamento-equilibrio-quimico.htm. Dostopno 28. junija 2021.
Kemija

Preizkusite svoje znanje in se naučite več s tem seznamom rešenih vaj o kemijskih tehtnicah. S pomočjo tega gradiva boste lahko bolje razumeli, kako delati ravnotežne konstante (Kp, Kc in Ki), ravnotežni premik, pH in pOH ter ravnotežje v tako imenovanih puferskih raztopinah.


