
Količina kalorij je odvisna od sestave hrane. Za eksperimentalno določitev količine toplote, ki jo odda hrana in ki jo telo lahko absorbira, uporabljamo napravo, imenovano kalorimeter.
Ta naprava meri toploto, ki jo odda hrana, ko je zgorela. Obstaja več vrst kalorimetrov; prvo izmed njih sta leta 1780 ustvarila Lavoisier in Laplace in je bila ledeni kalorimeter.
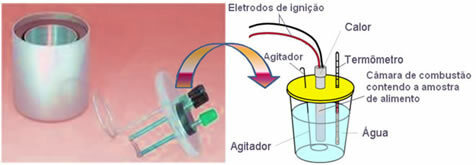
Dandanes je najbolj uporabljen in upošteva zgoraj razloženi koncept kalorij vodni kalorimeter. Ta naprava je prevlečena z izolacijskim materialom, da se prepreči izguba toplote iz medija; in hrana za analizo se postavi v zgorevalna komora, ki vsebuje plin kisik in elektrode. Te elektrode so pod električnim praznjenjem in povzročajo njihov vžig in izgorevanje hrane.
Znana masa vode, ki jo vsebuje kalorimeter, absorbira toploto, ki jo sprošča zgorela hrana in a termometer meri zvišanje temperature vode. Poleg tega kalorimeter vsebuje a mešalnik kar omogoča, da temperatura vode ostane v celoti enakomerna.
Torej, če uporabimo na primer maso 1 gram sladkorja in ima kalorimeter 1000 g vode, in opazimo, da na koncu reakcije je temperatura vode z 20 ° C na 24 ° C, to je povečala se je za 4 ° C, nato lahko dosežemo energijsko vrednost sladkor. Všeč? No, glede na začetni koncept kalorij imamo:
| Dvignite z 1 ° C → 1 cal na gram vode |
| Dvignite s 4 ° C → 4 cal na gram vode |
Torej 1 g vode absorbira 4 apna. Vendar je bilo porabljenih 1000 g vode in glede na to, da je vso toploto, ki se je sprostila pri zgorevanju, absorbirala, je celotna energija, ki jo je absorbirala voda, znašala 4000 cal ali 4 kcal. Zato sklepamo, da:
Ne ustavi se zdaj... Po oglaševanju je še več;)
| Energijska vrednost sladkorja = 4000 cal / g ali 4 kcal / g. |
Preoblikovanje v SI:
1 kcal 4,18 kJ
4 kcal / g x
x = 16,72 kJ / g
Poleg tega lahko za izračun količine toplote, ki jo voda odda ali absorbira, uporabimo naslednjo enačbo:
| Q = m. ç. t |
Kje:
Q = toplota, ki jo voda odda ali absorbira;
m = masa vode;
c = specifična toplota vode, ki je enaka 1,0 cal / g. ° C ali 4,18 J / g. ° C;
Δt = sprememba temperature, ki jo trpi voda, ki jo dobimo z znižanjem končne temperature za začetno (tf - tjaz).
S pomočjo te formule dobimo enak rezultat:
Q = m. ç. t
Q = 1000 g. 1,0 kal / g. ° C. (24-20) ° C
Q = 4000 kal
Q = 4,0 kcal
ali
Q = m. ç. t
Q = 1000 g. 4,18 kJ / g. ° C. (24-20) ° C
Q = 16,72 kJ
Avtorica Jennifer Fogaça
Diplomiral iz kemije
Bi se radi sklicevali na to besedilo v šolskem ali akademskem delu? Poglej:
FOGAÇA, Jennifer Rocha Vargas. "Merjenje kalorij v hrani s pomočjo kalorimetra"; Brazilska šola. Na voljo v: https://brasilescola.uol.com.br/quimica/medindo-as-calorias-dos-alimentos-por-meio-um-calorimetro.htm. Dostop 27. junija 2021.


